
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
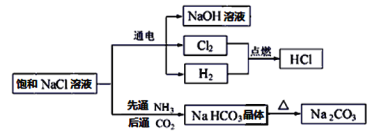
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
【答案】Na2CO3 NH3、CO2 ac Cl2 4.48 CO32-+H+=HCO3-
【解析】
(1)电解质是在水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物,非电解质是在水溶液中和在熔融状态下都不导电的化合物;
(2)化合反应特点为多变一,有化合价变化的为氧化还原反应;
(3)根据氧化还原反应的规律,还原剂对应的产物为氧化产物;对于![]() 。每生成2mol气体,转移电子数为2mol,据此来计算;
。每生成2mol气体,转移电子数为2mol,据此来计算;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠。
(1)饱和NaCl溶液、NaOH溶液属于混合物,Cl2、H2属于单质,HCl属于电解质但熔融状态不发生电离不导电,NH3、CO2属于非电解质,NaHCO3晶体属于电解质但受热易分解无熔融态,Na2CO3属于电解质熔融态能导电,故答案为:Na2CO3;NH3、CO2;
(2)反应![]() 属于化合反应,氧化还原反应,故答案为ac;
属于化合反应,氧化还原反应,故答案为ac;
(3)对于![]() Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-。


科目:高中化学 来源: 题型:
【题目】基本知识填空
(1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。
(2)化学平衡状态的特征:_____、____、_____、_____、_____。
(3)对于可逆化学反应mA+nBpC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。
(4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A是常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。请回答下列问题:
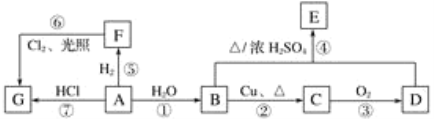
(1)写出A、D、G的结构简式:A________;D________;G________。
(2)A、B中官能团的名称:A________;B_________。
(3)在F的同系物中最简单的有机物的空间构型为____________。
(4)与F互为同系物且含有5个碳原子的同分异构体共有______种。
(5)写出下列编号对应反应的化学反应方程式,并注明反应类型:
①____________、________反应;
②___________________________________________、________反应;
④_________________________________________、________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L密闭容器里发生4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
4NO(g)+6H2O(g)反应半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
A. v(O2)=0.0010mol·L-1·s-1B. v(NH3)=0.00125mol·L-1·s-1
C. v(H2O)=0.0010mol·L-1·s-1D. v(NO)=0.0010mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B.1molCl2与足量Fe反应,转移的电子数为3NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Na2SO4固体来配制480mL0.2mol·L-1的Na2SO4溶液。可供选择的仪器如图:
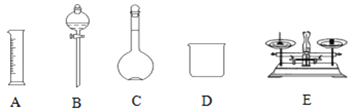
(1)如图所示的仪器中配制溶液不需要的是__ (填选项),配制上述溶液还需用到的玻璃仪器是___、__ (填仪器名称)。
(2)使用容量瓶之前必须进行的操作是___。(填选项)
A.检查气密性 B.检查是否漏水 C.烘干
(3)经计算,需Na2SO4的质量为___g。
(4)你选用的容量瓶规格为___mL。
(5)配制溶液时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其操作顺序:②→__→__→__→__→__→__(填序号)。___
(6)在配制过程中,其他操作都准确,定容时俯视刻度线会使所配溶液浓度__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
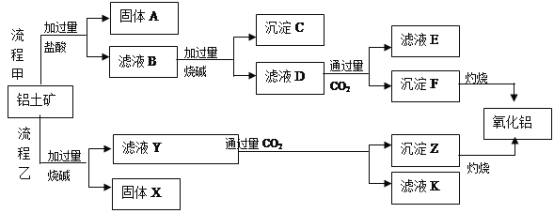
请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为_________________________________________.
(2)固体A的应用_________________________________________.(两点)
(3)滤液D与少量CO2反应的离子方程式为__________________________________,
向该滤液K中加入足量石灰水的离子方程式是________
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是__________________________
(5)已知298K时,![]() 的溶度积常数
的溶度积常数![]() =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的pH最小为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
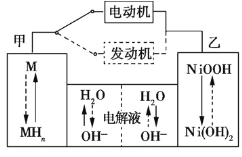
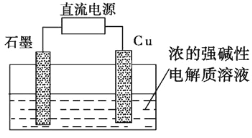
图1 图2
(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高药用价值的绿原酸(如图所示),下列说法不正确的是( )
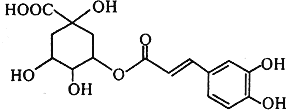
A. 绿原酸分子中有3个手性碳原子
B. 绿原酸能发生取代、加成、消去和氧化反应
C. 1mol绿原酸与NaOH溶液反应,最多消耗4mol NaOH
D. 绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com