
【题目】现将AlCl3、MgCl2、MgSO4、Al2(SO4)3四种物质溶于水,形成的混合溶液中c(Al3+)=0.1molL﹣1、c(Mg2+)=0.25molL﹣1、c(Cl﹣)=0.2molL﹣1 , 则该溶液中c(SO42﹣)为( )
A.0.15 molL﹣1
B.0.2 molL﹣1
C.0.25 molL﹣1
D.0.30 molL﹣1
科目:高中化学 来源: 题型:
【题目】下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是
A. KClO3是氧化剂 B. KCl既不是氧化产物也不是还原产物
C. HCl是还原剂 D. 每生成1molCl2消耗还原剂的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、O2、CH4三种气体,下列说法错误的是
A. 所占的体积由大到小的顺序是:CH4>O2>CO2
B. 所含分子数由多到少的顺序是:CH4>O2>CO2
C. 密度由大到小的顺序是:CO2>O2>CH4
D. 所含的电子数由多到少是:CO2>CH4>O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用水和N2制备NH3的电化学装置如图所示,下列说法错误的是

A. 该离子交换膜为阳离子交换膜
B. 阴极发生的电极反应为Li++e-==Li
C. 阳极发生的电极反应为4OH--4e-===2H2O+O2↑
D. 每生成1molNH3,电路中通过3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g) ![]() 4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=0.9 mol·L-1·min-1 B. v(B)=1.5 mol·L-1·min-1
C. v(D)=0.8 mol·L-1·min-1 D. v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是
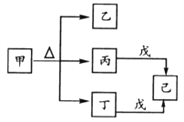
A. 甲和戊加入水中都能破坏水的电离平衡 B. 乙和戊都含有离子键
C. 原子半径r(D)>r(B)>r(C)>r(A) D. A、B、C形成的化合物一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。

(1)实验中使用肥皂液的作用是____________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行 了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08 g溶于足量盐酸中,向所得溶液中通入448 mLCl2(标准状况),恰好将Fe2+完全氧化。则x=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl 广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O 制备CuCl,并进行相关探究。
【资料查阅】得知:CuCl常温下是固体,露置于空气中易被氧化为绿色的高价铜盐。CuCl2·2H2O加热分解的情况如右图所示:
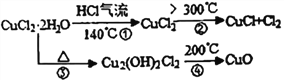
【实验探究】该小组用如图所示装置进行实验(夹持仪器已略)。

根据以上信息请回答下列问题:
(1)装置E的作用是____________________。
(2)实验操作的先后顺序是a→______________________(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)某同学设计的检验该装置气密性的方法是:将装置E上面的倒置漏斗换成导管,在烧杯中加少量水,将导管插入水中,在装置的气体入口处装上橡皮管,并用弹簧夹夹紧,用酒精灯微微加热玻璃管,若导管口有气泡冒出,撤去热源后,导管中有一段稳定的水柱,则装置气密性良好。你认为该同学的设计是否合理________(填“是”或“否”)。
(4)在实验过程中观察到C中纸条的颜色不变,D中纸条的先变红后褪色,其褪色的原因可能是________(填序号)。
A.氯化氢水溶液有漂白性 B.氯气的水溶液有漂白性
C.氯化氢气体有漂白性 D.干燥的氯气有漂白性
(5)停止通入HCl后,通入N2的目的是____________________。
(6)上述CuCl2·2H2O加热分解过程中④中发生反应的化学反应方程式是________________________。
(7)配平工业制备CuCl时发生反应的离子方程式:
Cu2++Cl-+SO32-+H2O→CuCl+H++SO42-,请依次写出配平后的化学计量数__________。
(8)准确称取所制备的氯化亚铜药品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。若滴定结束时,滴定管中有气泡,则样品中CuCl 的质量分数_________(填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com