
【题目】环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
科目:高中化学 来源: 题型:
【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞省去
夹持装置、活塞省去![]() 能够达到该目的是( )
能够达到该目的是( )
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护 | 酸化NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电压表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 配制1.000mol/LNaCl | NaCl | 容量瓶、烧杯、玻璃棒、试剂瓶 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠 | 大小试管、酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B. 2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试判断下列分子中心原子的杂化类型和分子构型。
(1)NI3:______;
(2)CH3Cl:______;
(3)CO2:______;
(4)BF3:______;
(5)H2O:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )
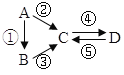
A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l) △H=-890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
BaSO4(s)+ H2O(l) △H<-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJmol-1
2NH3(g) △H=-38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9kJmol-1,4Al(s)+2O3(g)═2A12O3(s) △H=-3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中发生反应NH2COONH4(s)2NH3(g)+CO2(g),不能判断该反应已达到化学平衡的是( )
A. v正(NH3)=2v逆(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中总压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
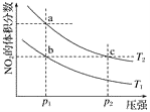
A. a、c两点的反应速率:a>cB. a、b两点的转化率:a<b
C. a、c两点气体的颜色:a深,c浅D. 由a点到b点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com