
【题目】在下列溶液中,若加入过量氨水或过量的氢氧化钠溶液,都产生沉淀,若加入铁粉,溶液能增重的是( )
A. FeCl3. B. FeCl2 C. AlCl3 D. MgCl2
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
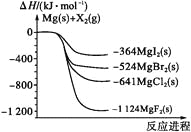
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通入CO气体,另一极通入O2和CO2混合气体,其总反应为:2CO+O2===2CO2 . 则下列说法中正确的是
A. 通CO的一极是电池的正极
B. 负极发生的电极反应是:O2+2CO2+4e-===2CO![]()
C. 负极发生的电极反应是:CO+CO![]() -2e-===2CO2
-2e-===2CO2
D. 通O2的一极做阴极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7 + 14HCl= 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O (用“单线桥”表示电子转移的方向和数目)___,氧化产物与还原产物的物质的量之比为_____________。
(2)______mol H2O中共含有9.03×1022个原子,其质量为_______。
(3)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —__MnSO4+__S↓+__K2SO4+__H2O
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5 mol, 则被氧化的NH3在标准状况下的体积为______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

(1)图中a极要连接电源的_____(填“正”或“负”)极,SO![]() 放电的电极反应_____________。
放电的电极反应_____________。
Ⅱ.在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
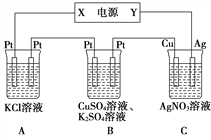
(2)溶液pH变化: B________,C________(填“增大”“减小”或“不变”)。
(3)通电5 min时,B中共收集224 mL气体(标准状况),溶液体积为200 mL。则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中足量的KCl溶液的体积也是200 mL,电解后,溶液的pH为_____(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。

(1)写出N2的一种用途_____________________。
(2)工业合成NH3的化学方程式为______________________。
(3)写出工业制硝酸第③步反应化学方程式_____________________。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:____________。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是(______)
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O(2分)
______ + ______ + N2O↑ + H2O(2分)
并配平其对应的离子方程式:__Fe2++__NO3-+__H+ =__Fe3++__N2O↑+__H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2分别投入下列物质的水溶液中,生成白色沉淀的是( )
A. BaCl2 B. K2SO4 C. CuCl2 D. Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaHCO3(Na2CO3) | 适量盐酸 | 蒸发结晶 |
B | CO2(CO) | O2 | 点燃 |
C | Mg(Al) | 氢氧化钠溶液 | 过滤 |
D | CO2(HCl) | 氢氧化钠溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com