

| 1 |
| 5 |
| 2.24L |
| 22.4L/mol |
| ||
|


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:不详 题型:单选题
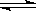 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。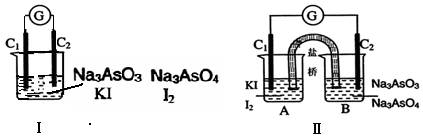
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2+2e-=2I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C+CO2=2CO |
| B.Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3?H2O+8H2O |
| C.CaC2+2H2O=Ca(OH)2+C2H2 |
| D.CH4+2O2=CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题




| A.甲表示H2与O2发生反应过程中的能量变化,则H2的烧热为483.6kJ·mol-1 |
| B.乙表示Cu形成金属晶体时的堆积方式 |
| C.丙装置中烧杯a中的溶液pH降低 |
| D.丁装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| C.纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com