
(12分)A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
(1)写出B的基态原子的核外电子排布式: 。
(2)A、C形成的分子极易溶于水,其主要原因是 。与该分子互为等电子体的阳离子为 。
(3)比较E、F的第一电离能:E F。(选填“>”或“<”)
(4)BD2在高温高压下所形成的晶胞如图所示 。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。
。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。

(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在 。(填序号)
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
(12分)
(1)1s22s22p2 (1分)
(2)NH3与H2O间能形成氢键 (2分) H3O+ (2分)
(3)> (1分)
(4)原子 (2分) sp3 (2分)
(5)acd (2分)(全对给分,有错不给分)
【解析】
试题分析:A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;则A是第一周期元素,所以A是H元素,则F是第三周期元素,则F是Al元素; B原子核外电子分处3个不同能级且每个能级上的电子数相同,则B的核外电子排布是1s22s22p2,则B是C元素;A与C形成的分子为三角锥形,H原子与N原子形成的氨气是三角锥型分子,所以C是N元素;D原子p轨道上成对电子数等于未成对电子数,则p轨道的电子排布是np4,所以D是第六主族元素,根据原子序数的关系,所以D是O元素;E原子核外每个原子轨道上的电子都已成对,E电负性小于F,则E元素是Mg元素。
(1)C的基态原子的核外电子排布式1s22s22p2;
(2)A、C形成的分子是氨气,极易溶于水,其主要原因因为氨气分子与水分子间形成氢键的缘故;与NH3互为等电子体的阳离子中含有4个原子,8个价电子,所以该阳离子为H3O+;
(3)Mg的3s有2个电子,是全充满的稳定状态,而Al的3p轨道是1个电子,不稳定,所以Mg的第一电离能大于Al;
(4)根据晶胞图可知,二氧化碳在高温高压下所形成的晶胞中,C、O以原子形式存在,微粒间的作用力则是共价键,所以是原子晶体;且每个C原子与4个O原子相连,每个O原子与2个C原子相连,所以C原子的杂化方式是sp3杂化;
(5)[Al(OH)4]-中O与H原子间形成共价键,且是σ键,铝离子存在空轨道,羟基的O原子中存在孤对电子,所以羟基与铝离子之间还形成配位键,答案选acd。
考点:考查元素的推断,物质的结构与性质,晶胞的判断,化学键的判断


科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:选择题
700℃时,向容枳为2L的密闭容器中充入一定量的CO和H2O发生反应:
CO(g)+H2O(g) 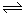 CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见表。下列说法正确的是

A.反应在t1min内的平均速率为v (H2)=0.4/t1 mol·L-1·min-1
B.其他条件不变,起始时向容器中充入0.60molCO和1.20 mo1H2O,到达平衡时,n(CO2)=0.40 mol
C.其他条件不变,向平衡体系中再通入0.2molH2O,达到新平衡时CO转化率减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.对于任何化学反应来说,反应速率越大,反应现象就越明显
B.在其他条件不变时,升高温度一定会加快化学反应的反应速率
C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态
D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:选择题
西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如下图所示。下列关于西瑞香素的结构和性质叙述正确的是

A.分子中所有原子可以处于同一平面
B.该物质能发生加成、氧化、水解、消去等反应
C.能与FeCl3溶液发生显色反应
D.1 mol该有机物最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:选择题
用下列实验装置进行相应的实验,能达到实验目的的是

A.图I所示装置制取干燥的氨气
B.图II所示装置用于提取I2的CCl4溶液中的I2
C.图III所示装置微热稀HNO3,在广口瓶中可收集NO气体
D.图IV所示装置可用于除去CO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省常州市高三上学期期末化学试卷(解析版) 题型:填空题
(15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省常州市高三上学期期末化学试卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是

A.①②③ B.③④ C.①③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校教研教改共同体高三第一次联考化学试卷(解析版) 题型:选择题
已知:甲+H2O→乙+丙,根据以上反应式进行的下列推断不合理的是
A.甲为Fe丙为 Fe2O3 B.甲为F2丙为 O2
C.甲为KH丙为 H2 D.甲为CaC2丙为C2H2
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省扬州市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示。下列叙述中正确的是

A.分子内消去一个水分子,产物有3种同分异构体
B.该物质可以视为酚类
C.能使溴的四氯化碳溶液褪色
D.该物质分子中的所有碳原子均共面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com