
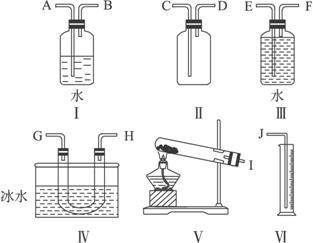
完成下列问题:
(1)试从图中选取几种必要的装置,连接成一整套实验装置,这些被选用装置的接口编号连接顺序为______________________________________________。
(2)观察到的三氧化硫的颜色和状态是___________,将三氧化硫与水反应,鉴定反应产物中阴离子的方法是___________________________。
(3)若实验时称取过二硫酸钾的质量为W g,测得氧气的体积(折算成标准状况)为a mL,则此过二硫酸钾的纯度为_________________。
(1)IGHFEJ(G、H的顺序可以颠倒)
(2)无色晶体 加入稀盐酸,无明显现象,再加BaCl2溶液,有白色沉淀生成 (3)![]() %
%
解析:此实验的原理是通过测定产物O2的体积,来确定反应物K2S2O8的纯度。因为是固体加热分解制取气体,所以选用装置Ⅴ;要测定O2的体积,需先用冰水冷却,将气体产物中的SO3分离出来,这样由G端(或H端)出来的气体产物仅是O2;由于是利用测量排出水的体积的方法来测定O2的体积,所以应选用装满水的集气瓶Ⅲ,为了将水压出来,气体必须从F端进入,使水从E端排出,用量筒Ⅵ收集并测量其体积。得到的SO3是无色晶体,它与水反应生成H2SO4,反应产物的阴离子是![]() ,可以用BaCl2溶液来鉴定;从题目中给出的化学反应方程式可知,2 mol K2S2O8分解产生1 mol O2,所以K2S2O8的纯度为
,可以用BaCl2溶液来鉴定;从题目中给出的化学反应方程式可知,2 mol K2S2O8分解产生1 mol O2,所以K2S2O8的纯度为![]() %。
%。


科目:高中化学 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。
(1)上述冶炼过程产生大量SO2。下列处理方案中合理的是_________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(2)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-====
+2I-====![]() +I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程:_____________、____________。(不必配平)
+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程:_____________、____________。(不必配平)
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是____________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为____________________________________________________________。
证明炉渣中含有FeO的实验现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO![]() +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年武汉二中高一上学期期中考试化学试卷 题型:填空题
(7分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO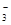 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O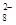 +2I-=2SO
+2I-=2SO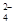 +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省灌南高级中学高三上学期期中考试化学试卷(带解析) 题型:填空题
(14分)黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I— 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com