
(4分,每空1分)如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小片镁片,再用滴管滴5mL稀盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式: 。
(4)由实验推知, 溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
(1)镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液变浑浊。
(2)镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小。
(3)Mg+2H+=Mg2++H2↑
(4)小于
解析试题分析:(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊。
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状。
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑,离子方程式为:Mg+2H+=Mg2++H2↑。
(4)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片的盐酸的总能量。
考点:本题考查实验现象的判断与分析、离子方程式的书写、化学反应与能量转化。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:单选题
化学反应H2+Cl2===2HCl的能量变化如图所示,则下列说法正确的是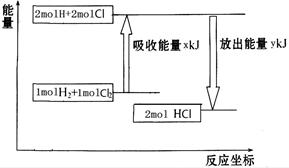
| A.该反应是放热反应 |
| B.断裂1 mol H—H键和1 mol Cl—Cl 键放出x kJ能量 |
| C.断裂1 mol H—Cl键需要吸收y kJ的能量 |
| D.2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=–2986kJ·mol-1
4P(s,红磷)+ 5O2=P4O10(s);ΔH=–2956kJ·mol-1
则白磷比红磷 (填“稳定”或“不稳定”)
(4) 已知一定条件下A2与B2自发反应生成AB3,则反应
A2(g)+3B2(g)=2AB3(g) 的ΔS= 0,ΔH 0 (填“<”、“>”、“=”)
(5)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗 银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(每空1分,共7分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。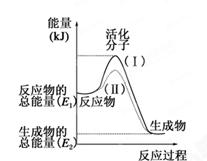
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)工业上常用天然气作为制备甲醇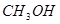 的原料。已知:
的原料。已知:
①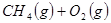
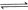
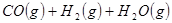
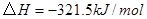
②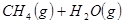
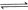
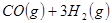
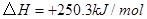
③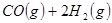
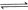
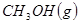
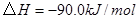
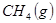 与
与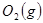 反应生成
反应生成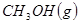 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入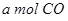 与
与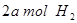 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: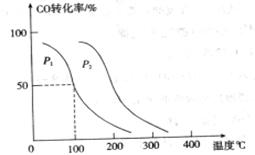
①压强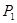
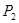 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在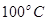 、
、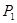 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含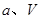 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是 。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
Ⅰ.氯碱工业中常用离子交换膜法电解制碱(如图1所示)。
(1)写出图1中阴极的电极反应式 。
(2)已知阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。工业上若用图2装置电解饱和Na2SO4溶液来生产纯净的NaOH和H2SO4,则该装置最主要的缺陷是 。
Ⅱ.辉钼矿(MoS2)是一种重要的矿物。图3是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图4给出了各炉层固体物料的物质的量百分含量。
已知:MoS2焙烧生成1molMoO3的反应热△H1=-1011KJ/mol;MoO2氧化生成1molMoO3的反应热△H2=-154KJ/mol。试回答: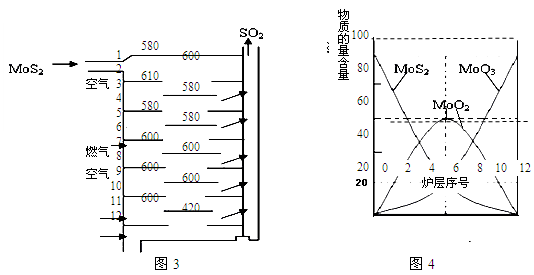
(1)验证辉钼矿焙烧生成的气体是SO2而不是SO3的方法是 。
(2)辉钼矿焙烧生成的气体能使硫酸酸化的KMnO4溶液褪色,用化学方程式表示褪色的原因 。
(3)第6炉层存在的固体物质分别是MoS2、MoO3、MoO2,则它们的物质的量之比为 。
(4)图4表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的热化学反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com