
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
分析 A.根据电子守恒判断,离子方程式两边电子不守恒;
B.氢氧化钠过量,铵根离子和铝离子都参与反应;
C.银氨络离子与乙醛发生氧化还原反应生成乙酸铵、氨气、银单质和水;
D.酸性溶液中,反应物中不会生成氢氧根离子.
解答 解:A.Cu与浓硝酸反应制备NO2,该反应不满足电子守恒,正确的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故A错误;
B.NH4Al(SO4)2溶液与过量NaOH溶液反应生成一水合氨、偏铝酸根离子和水,正确的离子方程式为:NH4++Al3++5OH-═AlO2-+2H2O+NH3•H2O,故B错误;
C.用银氨溶液检验乙醛中的醛基,反应的离子方程式为::CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故C正确;
D.用H2O2从酸化的海带灰浸出液中提取碘,产物不会生成氢氧根离子,正确的离子方程为:2I-+2H++H2O2═I2+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等),B为易错点,注意反应物过量情况对生成物的影响.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
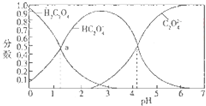
| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 | … |
| 平衡常数K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
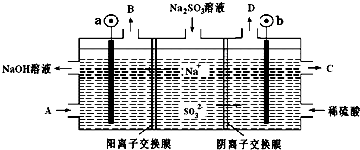
| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 粒子组 | 评价及离子方程式 |
| A | K+、Al3+、SO42-、NO3- | 能大量共存于同一溶液中 |
| B | H+、CH3CHO、SO42-、MnO4- | 能大量共存于同一溶液中 |
| C | NH4+、Fe3+、SCN-、Cl- | 不能大量共存,Fe3++3SCN-=Fe(SCN)3↓ |
| D | Na+、K+、HCO3-、OH- | 不能大量共存,HCO3-+OH-=H2O+CO2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com