
【题目】【2017届浙江省“七彩阳光”新高考研究联盟高三上考试】已知:H2O![]() OH-+ H+,在25 ℃和100 ℃时水的Kw分别为1.0×10-14、2.5×10-13。下列说法不正确的是
OH-+ H+,在25 ℃和100 ℃时水的Kw分别为1.0×10-14、2.5×10-13。下列说法不正确的是
A.25 ℃时,纯水的pH = 7呈中性
B.100 ℃时,纯水的pH < 7呈酸性
C.纯水的c(H+)100 ℃大于25 ℃
D.100 ℃的纯水中c(H+)= c(OH-)
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
|
| 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
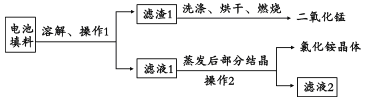
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
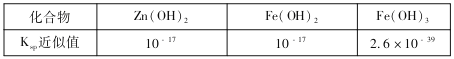
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是____________.调pH的最适宜范围为_______________
(2) 调PH过程中加入的试剂最好是_________
A.NaOH B.CuO C.NH3 ﹒H2O D.Cu2(OH)2CO3
(3)煮沸CuSO4溶液的原因是_____________________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式________________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________________。
(5) 称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol﹒L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol﹒L-1的Ce((SO4)2溶液滴定,到达终点时消耗Ce((SO4)2溶液25.00 mL。有关的化学反应为 Fe3++CuCl=Fe2++Cu2++Cl-, Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组离子中,能大量共存的( )
A. Ag+、NO3﹣、Na+、Cl﹣ B. K+、HCO3﹣、Cl﹣、Al3+
C. NO3﹣、Fe2+、H+、Br﹣ D. K+、Cl﹣、SO42﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;B称作冰片,可用于医药和制香精,樟脑等;C的核磁共振氢谱显示其分子中含有4种氢原子;D中只含一个氧原子,与Na反应放出H2;F为烃。仔细阅读以下转化关系:
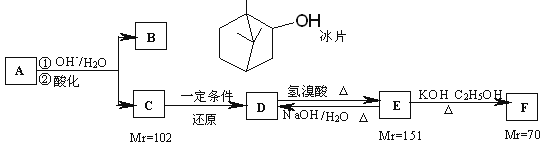

回答以下问题:
(1)B的分子式为__________。
(2)B不能发生的反应是___________(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应
(3)E→F的反应类型是____________。
(4)F的分子式为_________,化合物H是F的同系物,相对分子质量为56,H所有可能的结构有______种。
(5)用系统命名法给F命名的名称为______________。
(6)写出E→D的化学力程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a1。下列关系式中正确的是
A.a2=a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
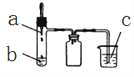
选项 | 实验试剂 | 实验现象 | 实验结论 | ||
a | b | c | |||
A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度相等的下列溶液:①醋酸、②盐酸、③苯酚钠、④苯酚、⑤碳酸钠、⑥碳酸氢钠、⑦硫酸、⑧氢氧化钠,按溶液pH由小到大排列正确的是
A.④①②⑦⑥③⑤⑧ B.④①②⑦⑤⑥③⑧
C.⑦①②④⑥③⑤⑧ D.⑦①④②③⑥⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com