
【题目】等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液B.稀H2SO4C.蔗糖溶液D.NaCl溶液
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()
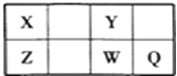
A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
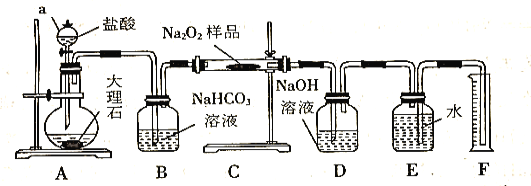
①装置D的作用是_________________________________;
②将仪器连接好以后,必须进行的第一步操作是_________________________________;
③写出装置C中发生主要反应的化学方程式_________________________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,足量的铝分别与下列酸反应时,放出H2最多的是 ( )
A. 600 mL 18.4mol·L-1的硫酸 B. 100 mL 1.0mol·L-1的盐酸
C. 200 mL 12 mol·L-1的浓硝酸 D. 600mL 0.1 mol·L-1的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和HCl的物质的量之比为________。写出化学方程式并用双线桥法标出电子转移_______________________________________________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
若生成2 mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学方程式
(1)乙炔与氯化氢按物质的量比1:1反应_____________________________________
(2)苯与浓硝酸、浓硫酸的混合酸共热_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为____________ (填序号) a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为 ____________ 。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→___→___→___→___→___→___→h
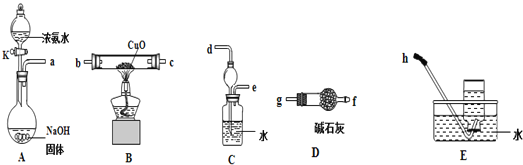
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为_____________________。
③装置C中的球形装置的作用是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com