
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。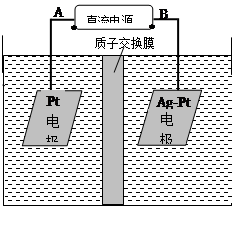
①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
(14分)
(1)①N≡N
②2NO3?+5H2 N2+2OH?+4H2O ,0.001
N2+2OH?+4H2O ,0.001
③加酸,升高温度,加水
(2)①A ,2NO3?+6H2O+10e?=N2↑+12OH?
②14.4
解析(1)①N2分子含氮氮三键,继而可写出结构式。
②根据题目所给条件,可知反应物为NO3?和H2,产物为N2和2OH?,根据原子守恒可推出还生成水,配平可得出离子方程式;溶液的pH由7变为12,可知生成的C(OH?)=0.01mol?L?1,则V(NO3?)= 0.01mol?L?1÷10min="0.001" mol?L?1?min-1。
③因为水解反应都是吸热反应,NO2-水解生成OH?,根据平衡移动原理,可知加酸,升高温度,加水,可促进NO2-的水解。
(2)①NO2-在阴极得电子生成N2,所以B极为电源的负极,则A极为电源的正极,根据原子守恒和电荷守恒,反应物还有H2O,生成物还有OH?。配平地离子方程式。
②除了电极反应会造成电解液的质量变化,质子通过质子交换膜导电也会产生电解液的质量变化,转移2mol电子,会有2molH+从左侧移动到右侧,使左侧电解液质量减少2g,右侧电解液质量增加2g
左侧电极反应为H2O电离的OH?放电:4OH?-4e?=2H2O+O2↑
4mol 32g
2mol 16g
所以转移2mol电子,左侧电解液共减少:16g+2g=18g
右侧电极反应为:2NO3? + 6H2O + 10e? = N2↑+12OH?
10mol 28g
2mol 5.6g
H+移向右侧,所以转移2mol电子,右侧电解液共减少:5.6g-2g=3.6g
因此两侧电解液的质量变化为:18g-3.6g=14.4g。
【考点定位】本题考查结构式和方程式的书写、反应速率的计算、水解平衡的移动、电极的判断和化学计算。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省新民市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
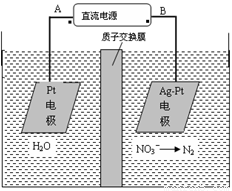
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷解析版) 题型:填空题
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。

①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 。
|
④在NaNO2 溶液中,质子守恒表达式为
___________________________________________。
(2)电化学降解NO3—的原理如右图所示。
| |
阴极反应式为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com