
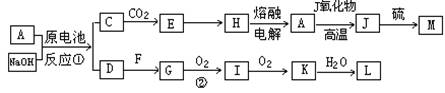
(12分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。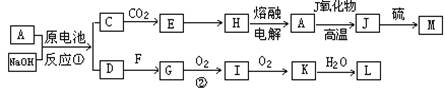
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)写出②的化学方程式____________________________________________________。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为 。
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
(12分)
(1)Al+4OH-–3e- = AlO2-+2H2O(2分)
(2)10-2–10-12 mol/L或c(OH-)–c(H+) (2分) < (1分)
(3)4NH3+5O2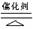 4NO+6H2O (2分)
4NO+6H2O (2分)
(4)①Al3++3HCO3- = Al(OH)3↓+3CO2↑ (2分)
②明矾(1分); 1mol/L(2分)
解析考点:无机物的推断;原电池和电解池的工作原理.
分析:(1)题中C→E→H→A→J的转化是中学化学中常见反应,H→A为工业冶炼金属铝,A→J为铝热反应,故应为AlO2-→Al(OH)3→Al2O3→Al→Fe的反应,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,负极上发生的反应为:
Al+4OH--3e-=AlO2-+2H2O;
(2)溶液C为NaAlO2,根据溶液呈电中性,即c(AlO2-)+c(OH-)=c(Na+)+c(H+),进行判断离子关系;
(3)反应②为工业合成氨的重要反应,反应为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(4)①根据弱酸的阴离子和弱碱的阳离子发生相互促进的水解来书写离子方程式;
②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,根据图象判断反应的物质的量的关系,以此计算.
解答:解:(1)题中H→A为工业冶炼金属铝,A→J为铝热反应,为推断题的突破口,依次可知C→E→H→A→J的转化是中学化学中常见反应,为AlO2-→Al(OH)3→Al2O3→Al→Fe之间的转化,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,可以推知:A为Al,C为NaAlO,E为Al(OH)3,H为Al2O3,J为Fe,M为FeS,原电池中,Al做负极被氧化,在碱性溶液中生成AlO2-,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(2)溶液C为NaAlO2,根据溶液呈电中性,即c(AlO2-)+c(OH-)=c(Na+)+c(H+)可知:c(Na+)-c(AlO2-)=c(OH-)-c(H+)=10-2-10-12 mol/L,故答案为:10-2-10-12 mol/L或c(OH-)-c(H+);
(3)原电池正极生成H2,即D为H2,则G为氢化物,由G→I→K的转化可知该氢化物中存在变价非金属元素,应为N元素,故G为NH3,I为NO,K为NO2,L为HNO3,反应②为工业合成氨的重要反应,反应为:4NH3+5O2 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2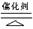 4NO+6H2O
4NO+6H2O
(4)①AlCl3水溶液与NaHCO3溶液反应相互促进的水解,反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,该反应为泡沫灭火器的反应原理,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,俗称为明矾或白矾;
根据反应计算:
Ba2++SO42-═BaSO4
1mol 233g
n 233g
则n=1mol,根据SO42-离子的守恒可知500mLKAl(SO4)2的溶液中含有溶质的物质的量为0.5mol,
故浓度为: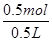 =1mol/L,故答案为:明矾或白矾;1mol/L.
=1mol/L,故答案为:明矾或白矾;1mol/L.
点评:本题考查元素化合物推断,同时考查电化学、晶体类型的判断、盐类的水解等知识,具有较高的综合度,本题具有一定的难度.


科目:高中化学 来源: 题型:
(12分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)写出②的化学方程式____________________________________________________。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为 。
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:填空题
(本题共12分)
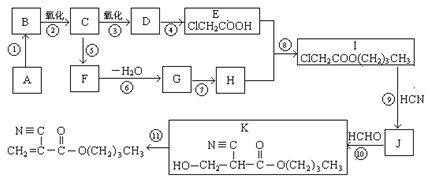
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为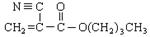 )
)
已知两个醛分子在一定条件下可以发生如下反应;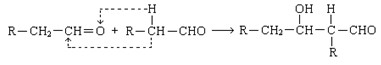
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是 。
2.⑥的反应条件是 ,I→J的另一生成物是 。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是 。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有 种。
6.如果以F为原料经过三步合成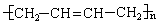 ,对应的反应类型分别为
,对应的反应类型分别为
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:填空题
(本题共12分)
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为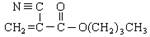 )
)
已知两个醛分子在一定条件下可以发生如下反应;
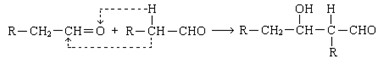
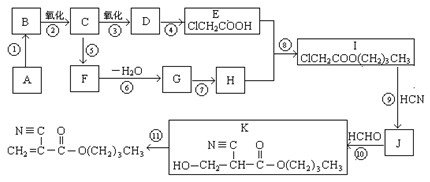
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是 。
2.⑥的反应条件是 ,I→J的另一生成物是 。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是 。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有 种。
6.如果以F为原料经过三步合成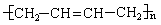 ,对应的反应类型分别为
,对应的反应类型分别为
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济宁金乡一中高三12月月考化学试卷 题型:填空题
(12分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)写出②的化学方程式____________________________________________________。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为 。
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
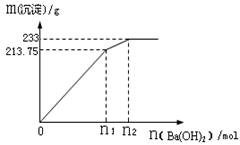
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com