
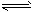 CH3OH(g)����H ����90��8 kJ��mol-1
CH3OH(g)����H ����90��8 kJ��mol-1 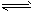 CH3OCH3(g) + H2O(g)����H����23��5 kJ��mol-1
CH3OCH3(g) + H2O(g)����H����23��5 kJ��mol-1  CO2(g) + H2(g)����H����41��3 kJ��mol-1
CO2(g) + H2(g)����H����41��3 kJ��mol-1 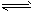 CH3OCH3(g) + CO2(g)�Ħ�H�� ___________��һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ���
CH3OCH3(g) + CO2(g)�Ħ�H�� ___________��һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ���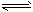 CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g) + H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£� 
 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�����Ƕ�ģ ���ͣ���ѡ��
| ʱ�� | c ��H2��/mol?L-1 | c ��CH3OH��/mol?L-1 | v��������v ���棩 �Ƚ� |
| t0 | 6 | 0 | �� |
| t1 | 3 | 1 | v������=v���棩 |
A��t0��t1ʱ���ڦԣ�H2��=
| ||
| B��t1ʱ���������¶Ȼ��ٳ���CO2���壬���������H2��ת���� | ||
| C��t0ʱ��v��������v���棩 | ||
| D��T��ʱ��ƽ�ⳣ��K=1/27��CO2��H2��ת������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ƽ��������Ӧ�����ƶ� | B��ƽ�����淴�����ƶ� |
| C��ƽ�ⲻ�����ƶ� | D��n��C����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| T/K | T1 | 573 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
| 1 |
| 7 |
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������¶�ʱ������Ӧ���ʼӿ졢�淴Ӧ���ʼ��� |
| B����x=1������������ֲ��䣬��ƽ����E���������Ϊ50% |
| C����x=2������������ֲ��䣬��ƽ����F��ƽ��Ũ��Ϊ0.5amol?L-1 |
| D����x=2������ѹǿ���ֲ��䣬��ƽ����E�����ʵ���Ϊamol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| c(CO2) |
| c(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ����ĩ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com