
【题目】纳米级Fe粉是新型材料,具有超强磁性、高效催化性。某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉。其实验设计如图(加热、支持装置省略):

(1)a的名称是________________;浓硫酸的作用是________________。
(2)打开分液漏斗活塞,一段时间后再对C装置加热,这样操作的目的是_______________;反应一段时间后D中变蓝,E中溶液变浑浊,C中发生反应的化学方程式为______________。
(3)反应中若观察到B装置中气泡产生过快,则应进行的操作是_____________________。
(4)反应一段时间后,B中产生气泡太慢,再滴加硫酸,反应速率略有加快但不明显;若向硫酸中加少量硫酸铜,再滴入硫酸与Zn反应,反应速率明显加快,原因是__________________。
(5)检验碳酸亚铁中含有铁元素的实验方法是____________________________。
【答案】(1)蒸馏烧瓶,吸收氢气中的水蒸气(或干燥氢气);
(2)排除体系内的空气,防止干扰实验,防止爆炸,FeCO3+H2![]() Fe+CO2+H2O;
Fe+CO2+H2O;
(3)调节A中分液漏斗活塞,减慢硫酸滴加速度
(4)锌与硫酸铜反应生成铜,铜与锌形成原电池(锌为负极),加快了反应速率
(5)取少量FeCO3加适量盐酸完全溶解,再加入少量K3[Fe(CN)3]溶液,产生蓝色沉淀,则碳酸亚铁中含有铁元素。(溶解后加入氧化剂,检验Fe3+也可)
【解析】
试题分析:(1)根据仪器a的构造可知a为蒸馏烧瓶;装置A为氢气的发生装置,用氢气还原装置C中的碳酸亚铁,氢气必须干燥,故装置B中浓硫酸的作用是吸收氢气中的水蒸气(或干燥氢气)。
(2)打开分液漏斗活塞,一段时间后再对C装置加热,这样操作的目的是排除体系内的空气,防止干扰实验,防止爆炸;反应一段时间后D中变蓝,E中溶液变浑浊,则C中氢气和碳酸亚铁反应生成铁、二氧化碳和水,发生反应的化学方程式为FeCO3+H2![]() Fe+CO2+H2O 。
Fe+CO2+H2O 。
(3)反应中若观察到B装置中气泡产生过快,则应调节生成氢气的生成速率,进行的操作是调节A中分液漏斗活塞,减慢硫酸滴加速度。
(4)若向硫酸中加少量硫酸铜,再滴入硫酸与Zn反应,反应速率明显加快,原因是锌与硫酸铜反应生成铜,铜与锌形成原电池(锌为负极),加快了反应速率。
(5)检验碳酸亚铁中含有铁元素即为Fe2+,实验方法是取少量FeCO3加适量盐酸完全溶解,再加入少量K3[Fe(CN)3]溶液,产生蓝色沉淀,则碳酸亚铁中含有铁元素(溶解后加入氧化剂,检验Fe3+也可)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g),△H>0请回答下列问题:
P(g)+Q(g),△H>0请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_____________;
(2)若反应在相同条件下进行达到平衡后,再向容器中充入M气体,再次达到平衡时该反应的平衡常数K_________(填“增大”“减小”或“不变”下同)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1, c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe-3e- = Fe3+
B.碱性介质甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH-
C.Mg — Al及NaOH溶液构成的原电池中负极材料为Mg
D.氯碱工业中阳极上产生的气体比阴极上产生的气体多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的叙述中错误的是( )
A.苯在催化剂作用下能与浓硝酸发生取代反应
B.在一定条件下苯能与氢气气发生加成反应
C.在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色
D.在苯中加入溴水,振荡并静置后下层液体为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2 (SO4)3、A12O3和Fe2O3,在一定条件下可实现下图所示的变化.
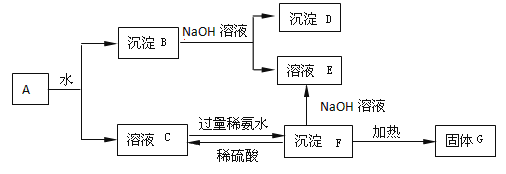
请回答下列问题:
(1)图中分离沉淀B与溶液C的方法是____________________。
(2)D、E、F这3种物质的化学式分别为:D:_______E:_______F:_________
(3)沉淀B与NaOH溶液反应的离子方式为__________;溶液C与过量稀氨水反应的离子方程式为_______________。
(4)检验溶液中是否含有Fe3+,最佳试剂是___________,现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到l.l2LH2,Fe和Fe2O3均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A.2.25mol/L B.2mol/L C.4mol/L D.0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液中共存,且加入盐酸过程中,会产生气体和沉淀的是( )
A.Na+、NO3-、AlO2-、SO42-
B.Na+、NO3-、SiO32-、K+
C.K+、Cl-、AlO2-、CO32-
D.K+、Cl-、HCO3-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
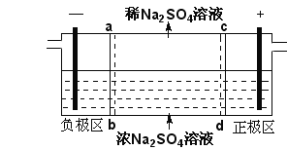
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com