
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
. 分析 (1)5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,则
浓度 N2(g)+O2(g)?2NO(g),
开始 1.3 1.5 0
转化 0.5 0.5 1
平衡 0.8 1 1
①结合v=$\frac{△c}{△t}$、K为生成物浓度幂之积与反应物浓度幂之积的比计算;
②结合平衡前速率、物质的量均在变化分析;
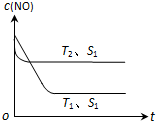
(2)①由图可知,T2先达到平衡,温度高,且对应NO的浓度高,即升高温度平衡逆向移动;
②若催化剂的表面积S1>S2,平衡时浓度不变,但S1对应的速率大,时间短.
解答 解:(1)5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,则
浓度 N2(g)+O2(g)?2NO(g),
开始 1.3 1.5 0
转化 0.5 0.5 1
平衡 0.8 1 1
①5min内该反应的平均速率υ (NO)=$\frac{1mol/L}{5min}$=0.2 mol•L-1•min-1,K=$\frac{{1}^{2}}{0.8×1}$=1.25,故答案为:0.2 mol•L-1•min-1;1.25;
②a.混合气体质量、体积不变,则密度始终不变,故不选;
b.该反应为气体物质的量不变的反应,混合气体的压强始终不变,故不选;
c.正反应速率在平衡前一直减小,达到平衡时不变,故选;
d.单位时间内,N2和NO的消耗量之比一直在变化,不变时达到平衡,故选;
故答案为:c d;
(2)①由图可知,T2先达到平衡,温度高,且对应NO的浓度高,即升高温度平衡逆向移动,则该反应的△H<0,故答案为:<;
②若催化剂的表面积S1>S2,平衡时浓度不变,但S1对应的速率大,时间短,画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为 ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡计算,为高频考点,把握图中浓度的变化、速率及K的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡三段法的应用,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应 反应类型取代反应
反应类型取代反应 反应类型取代反应
反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
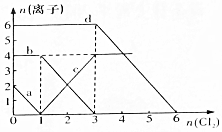 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com