
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 1:3 B.2:3 C.3:2 D.3:1
科目:高中化学 来源: 题型:
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.15 mol CuO B.0.1 mol CuCO3
C.0.075mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6FeSb4O6+6FeS②Sb4O6+6C
4Sb+6CO↑,关于反应①、②的说法正确的是( )
A. 反应①②中的氧化剂分别是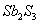 、
、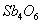
B.反应②说明高温下C的还原性比Sb强
C.反应①中每生成1mol FeS时,共转移3mol电子
D. 每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
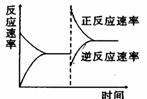
右图是关于反应A2(g)+3B2(g) 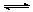 2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A.H2O(g)===H2(g)+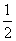 O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+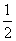 O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) == NH2CO2 NH4(s) △H= —l59.5 kJ·mol-1
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1) == H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素均为短周期元素,原子序数依次增大。
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, 纯净的Z是现代光学及光纤制品的基本原料,可与氢氟酸反应。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示)_____________________________________
(2)M可以使溴水褪色,写出该反应的离子方程式
(3)Z与氢氟酸反应的化学方程式
(4)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的化学方程式为
(5)D元素离子的电子结构示意图为__________
D在纯氧中燃烧产物里DO3含量 D在空气中燃烧产物里DO3含量。
用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单
质,该方法的优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列从反应物到生成物能通过化合反应一步制得的是(其他反应物自选)( )
A.Al2O3―→Al(OH)3
B.Fe(OH)2―→Fe(OH)3
C.Na2O2―→NaOH
D.NaAlO2―→Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com