
右图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体,A为金属单质,D在C中燃烧发出苍白色火焰,生成J,B是J的水溶液,H是红褐色沉淀。它们存在如图转化关系,反应中部分物质已略去。
(1)写出有关物质的化学式:
C______________,E_____________,F______________, H_____________。
(2)写出A+B→D+E的离子方程式
__________________________________________
(3)写出G→H的化学方程式____________________________________________________

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:阅读理解

| [H2][CO] |
| [H2O] |
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
| 0.2×0.4 |
| 0.1 |
| 0.2×0.4 |
| 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
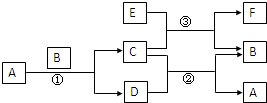 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三上学期期中考试化学试卷 题型:填空题
右图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物。它们存在如图所示的转化关系,反应中生成的水及次要产物均已略去。

(1)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(2)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(3)写出B与MnO2共热获得D的化学方程式 。
(4)写出B与F反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物。它们存在如图所示的转化关系,反应中生成的水及次要产物均已略去。
(1)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(2)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(3)写出B与MnO2共热获得D的化学方程式 。
(4)写出B与F反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com