
已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、OO和OH键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
科目:高中化学 来源: 题型:
一定条件下,反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n molA2的同时消耗n molB2
B.容器内, AB、A2、B2三种气体共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸二甲酯(DMC)是一种新型的绿色有机合成中间体,其在生产中具有使用安全、方便、污染少、容易运输等特点。已知一定条件下,碳酸二甲酯能发生如下反应:
反应①: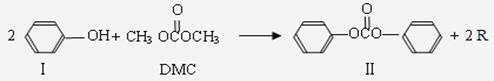
反应②: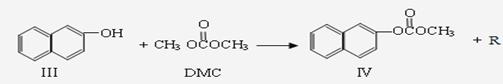
(1)化合物Ⅲ的分子式为 ,反应①和反应②中R的结构简式为 。
(2)DMC与足量NaOH溶液反应的化学方程式 。
(3)类似于反应①,DMC与乙酸苯酯(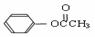 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
A.G的名称是甲酸乙酯 B.丙酸和G互为同分异构体
C.一定条件下,G能发生水解反应 D.G能与新制Cu(OH)2反应生成红色沉淀
(4)反应①中反应物用量不同,可得到化合物H(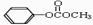 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体 。
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体 。
A.遇FeCl3溶液显紫色,B.苯环上的核磁共振氢谱有两组峰,C.能发生银镜反应
(5)以碳酸二甲酯合成杀虫剂西维因的路线如下:
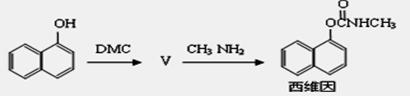
其中生成物Ⅴ的反应类似于反应②,则Ⅴ的结构简式为 ,1mol西维因最多可与 mol H2发生加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
由X、Y两种元素组成的离子化合物A。在空气中充分灼烧得到含X元素的16g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得93.2g固体。
(1)写出A的电子式 。
(2)在此过程中,消耗5 mol/L的双氧水的体积至少为 。
(3)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,则该反应的化学方程式 。
(4)将化合 物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是_______;
物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B |
|
|
|
| 升高温度,平衡常数减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
| C | D |
|
|
|
| t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________________。
(2)反应AX3(g)+X2(g)AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
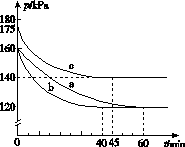
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO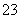 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:
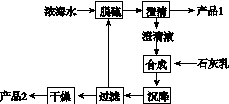
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为______________________________,产品2的化学式为__________,1 L浓海水最多可得到产品2的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为________________________;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A 生成物能量一定低于反应物总能量
B 放热反应的反应速率总是大于吸热反应的反应速率
C 英语盖斯定律,可计算某些难以直接侧脸房的反应焓变
D 同温同压下, 在光照和点燃条件的
在光照和点燃条件的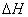 不同
不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com