
| A�� | ˫��ˮ����ϡ�����KI��Һ��H2O2+2H++2I-�TI2+2H2O | |
| B�� | ��100 mL 2 mol/L FeBr2��Һ��ͨ��4.48 L����������£�����ַ�Ӧ��2Fe2++2Br-+2Cl2�T2Fe3++Br2+4Cl- | |
| C�� | ��Na2CO3��Һ�е����̪��Һ����Һ��죺CO32-+H2O?HCO3-+OH- | |
| D�� | ��NaHCO3��Һ�м�������ij���ʯ��ˮ�����ְ�ɫ������2HCO3-+Ca2++2OH-�TCaCO3��+CO32-+2H2O |
���� A��˫��ˮ����ǿ�����ԣ��ܹ��������������ɵⵥ�ʣ�
B���ֱ����n=cV��n=$\frac{V}{{V}_{m}}$������廯���������������ʵ������������ӵĻ�ԭ�Դ��������ӣ���������ʱ�����������ȱ�������ʣ������������������ӣ�
C��̼������Һ�У�̼������Ӳ���ˮ������̼��������Ӻ����������ӣ���Һ�ʼ��ԣ�
D���������ƹ�������Ӧ����̼��Ƴ������������ƺ�ˮ��
��� �⣺A��˫��ˮ����ϡ�����KI��Һ����Ӧ���ɵⵥ�ʺ�ˮ����Ӧ�����ӷ���ʽΪ��H2O2+2H++2I-�TI2+2H2O����A����
B����100 mL 2 mol/L FeBr2��Һ�к����廯���������ʵ���Ϊ��2mol/L��0.1L=0.2mol��0.2mol FeBr2�к���0.2molFe2+��0.4molBr-����״����4.48L���������ʵ���Ϊ��$\frac{4.48L}{22.4L/mol}$=0.2mol��0.2mol����������������0.1mol������ʣ���0.1mol�����ܹ�����0.2mol�����ӣ���μӷ�Ӧ���������Ӻ������ӵ����ʵ�����ȣ���Ӧ�����ӷ���ʽΪ��2Fe2++2Br-+2Cl2�T2Fe3++Br2+4Cl-����B����
C����Na2CO3��Һ�У�̼������ӷ���ˮ�ⷴӦ��CO32-+H2O?HCO3-+OH-����Һ�ʼ��ԣ�������̪��Һ���죬��C��ȷ��
D����NaHCO3��Һ�м�������ij���ʯ��ˮ�����е�̼������Ӷ���ȫת����̼��Ƴ�������ȷ�����ӷ���ʽΪ��HCO3-+Ca2++OH-�TCaCO3��+H2O����D����
��ѡD��
���� ���⿼�������ӷ���ʽ���жϣ�Ϊ�߿��ĸ�Ƶ�⣬��Ŀ�ѶȲ���ע���������ӷ���ʽ����дԭ����ȷ���ӷ���ʽ�����жϳ��÷�������鷴Ӧ��������Ƿ���ȷ���������ʲ���Ƿ���ȷ���������������ʵ���Ҫ������ѧʽ������Ƿ����ԭ��ѧ����ʽ�ȣ�������ػ���֪ʶ�Ŀ��飬������ѧ���ķ������������Ӧ��������


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
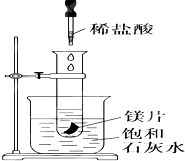 ��ͼ��ʾ�����Թܷ���ʢ��25�汥�ͳ���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���10mL�������Թ��У��Իش��������⣺
��ͼ��ʾ�����Թܷ���ʢ��25�汥�ͳ���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���10mL�������Թ��У��Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 84g | B�� | 32g | C�� | 87g | D�� | 197g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ά�� | B�� | ���� | C�� | ֲ���� | D�� | ��ѿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L��Һ��K+Ũ����0.4 mol•L-1 | |
| B�� | ��Һ�к���0.4NA��K+ | |
| C�� | 1 L��Һ������K+��SO42-����Ϊ0.3NA | |
| D�� | 2 L��Һ��SO42-Ũ����0.4 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| װ�� | ҩƷ | ���� | |
| ʵ��1 |  | 0.64g CuƬ��0.01mol����20.0mLŨHNO3 | CuƬ��ʧ���õ���ɫ��ҺA�����ýϳ�ʱ���õ���ɫ��ҺB���� |
| ���� | ���� | |
| ʵ��3 | i����������ҺA��c��H+����ͬ��HNO3��Һ��ȡ20.0mL��ͨ��NO2���� | ��Һ�ʻ�ɫ |
| ii���ټ�0.01mol Cu��NO3��2�����������ȫ�ܽ� | ��Һ��Ϊ��ɫ | |
| 3����ˮϡ�� | ��Һ������Ϊ��ɫ | |
| ʵ��4 | i����20.0mL 0.5mol/L Cu��NO3��2��ɫ��Һ��ͨ������NO2 | ��Һ����ɫ |
| ii������ϡH2SO4 | ����ɫ����ų��������������ɫ����Һ�ܿ��Ϊ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������0.1 mol Znʱ���õ��Ļ�ԭ����Ϊ0.1 mol | |
| B�� | ����Һ�в��ٲ�������ʱ����Һ�д������ڵ���������Zn2+ | |
| C�� | ���е����ֵ�������ʱ�����ĵ�п���������ٴ���13 g | |
| D�� | ��Ӧ����ʱ���ɵõ�0.25 mol ZnSO4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com