
| 化学键 | N≡N | H—H | N—H |
| 键能kJ·mol-1 | 946 | 436 | 390 |
 2NH3(g) ΔH=-86kJ/mol
2NH3(g) ΔH=-86kJ/mol

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源:不详 题型:填空题
 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题: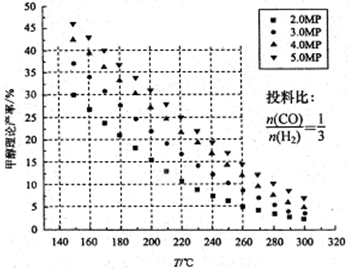
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.330 kJ | B.276.67 kJ | C.130 kJ | D.76.67 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
 X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 |
| B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
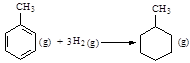 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。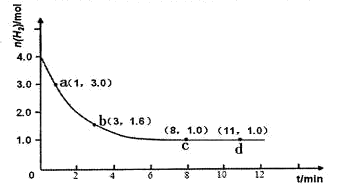

 CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 L氟化氢气体分解成1 L氢气和1 L氟气吸收270 kJ热量 |
| B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量小于270 kJ |
| C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com