
| m |
| M |
| m |
| M |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形 |
| B、s轨道都是球形轨道 |
| C、轨道不同,电子云的取向不一样 |
| D、电子云图是形象地描述电子在空间单位体积内出现概率大小的图形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
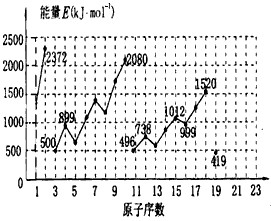
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
| c(NH | + 4 |
| c(SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com