
【题目】下列物质互为同分异构体的一组是( )
A.CH3OCH3和 CH3CH2OH
B.甲烷和乙烷
C.35Cl与37Cl
D.白磷和红磷
科目:高中化学 来源: 题型:
【题目】某单原子分子构成的气体,其摩尔质量为M g/mol,该气体的质量为mg,设阿伏加德罗常数的值为NA,则下列说法错误的是 ( )
A. 该气体在标准状况下的密度为2240/M
B. 该气体所含的原子总数为mNA/M
C. 该气体在标准状况下的体积为22.4m/M L
D. 该气体一个分子的质量为M/NA g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:
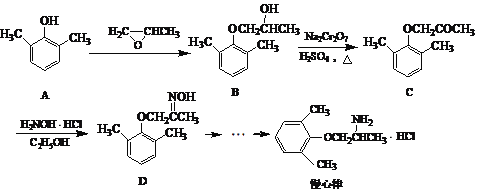
(1)由B→C的反应类型为______________。
(2)写出A与浓溴水反应的化学方程式______________________________________。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为________________________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式________________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个甲基。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(![]() )写出以邻甲基苯酚(
)写出以邻甲基苯酚(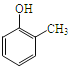 )和乙醇为原料制备
)和乙醇为原料制备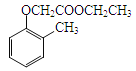 的合成路线流程图(无机试剂任用)___________
的合成路线流程图(无机试剂任用)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是 ( )。
A.酯化反应是有限度的B.酯化反应可看成取代反应的一种
C.酯化反应的产物只有酯D.浓硫酸可做酯化反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置___(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置___。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为____。
(3)装置A中①的名称是_____,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是______。
(4)粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④过滤 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发,操作顺序合理的是_____(选填项字母)
a.⑤②③①④⑥⑦ b.⑤①②③④⑥⑦ c.⑤②①③⑥④⑦ d.⑤③②①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
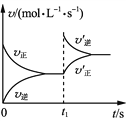
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中含Cl-物质的量浓度最大的是
A. 20mL0.2mol/L的AlCl3溶液 B. 40mL0.2mol/L的CaCl2溶液
C. 60mL0.4mol/L的KCl溶液 D. 100mL0.4mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
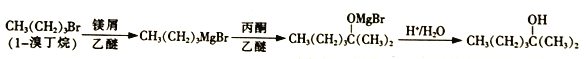
已知:RMgBr化学性质活泼,易与H2O、R'X等发生反应生成RH、R-R'。
(1)仪器A的名称是___________。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____,若镁屑不足,则反应时生成的有机副产物为________(填结构简式)。

(3)干燥管中无水氯化钙的作用为__________。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要作用。
( I )下列关于实验的叙述中正确的有______________(填字母)。
A.酒精灯使用结束后,应立即吹灭
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.取用Na2SO4溶液时,发现取量过多,为了不浪费,应把多余的试剂倒入原试剂瓶中
E.称量氢氧化钠固体时,应先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
F.使用分液漏斗前要检查其是否漏水
G.测量溶液pH时,应先将pH试纸润湿
( II )化学家研究物质的组成和性质时,首先需要将被研究的物质从混合物中分离出来并加以提纯,以下是常见的可用于分离或提纯物质的部分仪器和方法:
仪器:

方法:① 过滤;② 结晶;③ 蒸馏;④ 萃取分液。
请将相应的字母填入空白处:
实验 | 所需仪器 | 方法 |
除去水中混有的泥沙 | _______ | _______ |
从海水中获取淡水 | _______ | _______ |
分离碘和水的混合物 | _______ | _______ |
从海水中获取粗盐 | _______ | _______ |
( III ) 实验室用63%的浓HNO3 (其密度为1.4 g·mL-1)配制480 mL 0.25 mol·L-1稀HNO3;可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.托盘天平 f.10 mL量筒 g.50 mL量筒
回答下列问题:
(1)此浓硝酸的物质的量浓度为________mol·L-1。
(2)量取63%的浓硝酸时应选用________(填仪器的字母编号)量取________mL。
(3)实验时,上述仪器中还需要选用的有_________(填字母),还缺少的仪器有_______、_____ (写仪器名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏低的是________________ (填序号)。
①用量筒量取浓硝酸时,眼睛俯视刻度线
②容量瓶使用时底部残留有水
③定容时眼睛俯视刻度线
④移液时不小心有少量液体洒到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com