
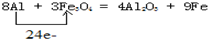 ,故答案为:
,故答案为: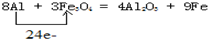 ;
;

科目:高中化学 来源:贵州省遵义四中2010-2011学年高二上学期期末考试化学文科试题 题型:022
铁和铝是两种重要的常见金属.请回答:
(1)将烧得红热的铁丝伸入盛有氯气的集气瓶中,可观察到有棕黄色的烟生成.
该反应的化学方程式为________.
(2)常温下,将铁、铝放入浓硝酸中,可发生钝化现象,是由于浓硝酸具有________.
(3)红热的铁高温下与水蒸气反应的方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)镁与稀硫酸反应的离子方程式为_____________________________________________。
(2)铝与氧化铁发生铝热反应的化学方程式为_____________________________________。
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀,其中正极的电极反应为_____________________________________________________________________。
(4)在海洋工程上,通常用铝合金(AlZnCd)保护海底钢铁设施,其原理如下图所示:

其中负极发生的电极反应为______________________________________________________;
在实际应用中,用铝合金而不选用纯铝。纯铝不能很好地起到保护作用,其原因是______。
(5)将11.9 gMg-Al-Fe组成的合金溶于足量NaOH溶液中,合金质量减少
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高一上学期期中考试化学试卷(解析版) 题型:填空题
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
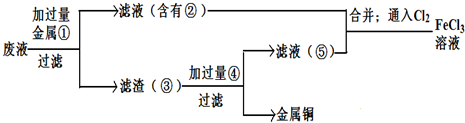
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:

请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省高三上学期第三阶段考试化学试卷(解析版) 题型:填空题
镁、铝、铁是重要的金属,在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 ;
(2)铝与氧化铁发生铝热反应的化学方程式为 ;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应式为 ;
(4)铝在空气中具有很好的抗腐蚀性能,铝制品在日常生活中被广泛应用。在海洋工程上,通常用铝合金(Al—Zn—Cd)保护海底钢铁设施,其原理如图18所示:
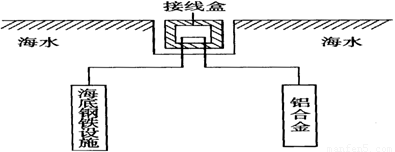
其中负极发生的电极反应为 ;
在实际应用中,用铝合金而不选用纯铝。纯铝不能很好地起到保护作用,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com