
【题目】氯气是一种重要的工业原料.
(1)Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 .
(2)Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验.
回答下列问题:
①该实验中A部分的装置是(填标号).
②请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): .
③写出D装置中发生反应的离子方程式 .
④该实验存在明显的缺陷,请你提出改进的方法 .
⑤该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1molL﹣1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)b;取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;Cl2+H2O═H++Cl﹣+HClO;H++HCO ![]() ═CO2↑+H2O;应将尾气通入NaOH溶液中;35.75%.
═CO2↑+H2O;应将尾气通入NaOH溶液中;35.75%.
【解析】解:(1)Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,反应的方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)Ⅱ.①依据方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;(2)Ⅱ.①依据方程式MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O可知,反应物质为液体与固体,反应条件为加热,应选属于“固+液
MnCl2+Cl2↑+2H2O可知,反应物质为液体与固体,反应条件为加热,应选属于“固+液 ![]() 气”型的b;故答案为:b;②Na2SO3氧化的产物为Na2SO4 , 确定存在SO
气”型的b;故答案为:b;②Na2SO3氧化的产物为Na2SO4 , 确定存在SO ![]() 即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO
即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO ![]() 的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化;故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;③进入D的Cl2与水反应的离子方程式为Cl2+H2OH++Cl﹣+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO
的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化;故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;③进入D的Cl2与水反应的离子方程式为Cl2+H2OH++Cl﹣+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO ![]() =CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应;故答案为:Cl2+H2OH++Cl﹣+HClO;H++HCO
=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应;故答案为:Cl2+H2OH++Cl﹣+HClO;H++HCO ![]() =CO2↑+H2O;④NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中;故答案为:应将尾气通入NaOH溶液中;⑤依据题干给出方程式可得:Ca(ClO)2~2Cl2~2I2~4Na2S2O3 , n[Ca(ClO)2]=
=CO2↑+H2O;④NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中;故答案为:应将尾气通入NaOH溶液中;⑤依据题干给出方程式可得:Ca(ClO)2~2Cl2~2I2~4Na2S2O3 , n[Ca(ClO)2]= ![]() n(Na2S2O3)=20.0 mL×10﹣3 LmL﹣1×0.1 molL﹣1×
n(Na2S2O3)=20.0 mL×10﹣3 LmL﹣1×0.1 molL﹣1× ![]() ×
× ![]() =0.005 mol,Ca(ClO)2%=
=0.005 mol,Ca(ClO)2%= ![]() ×100%=35.75%;
×100%=35.75%;
故答案为:35.75%;
Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水;Ⅱ.(1)根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置;(2)Na2SO3氧化的产物为Na2SO4 , 确定存在SO42﹣即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32﹣的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化;(3)进入D的Cl2与水反应的离子方程式为Cl2+H2OH++Cl﹣+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3﹣=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应;(4)NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中;(5)依据关系式Ca


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 NH4+、 Mg2+、 Ba2+、 Cl-、 SO42—、 CO32—。
将该混合物溶于水后得澄清溶液。 现取3份100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加 AgNO3溶液 | 有白色沉淀生成 |
B | 加足量 NaOH 溶液并加热 | 收集到气体 1.12 L(标准状况下) |
C | 加足量 BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥称量 | 第一次称量沉淀质量为6.63 g,第二次称量沉淀质量为4.66 g |
试回答下列问题:
(1)根据实验A判断 Cl-是否存在_____(填“一定存在” 、 “一定不存在” 或“不能确定”)。
(2)该混合物中一定不存在的离子是_____。
(3)写出实验B发生反应的离子方程式_____________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
(5)混合物中是否存在 K+?_____(填“存在” 或“不存在” )
①如果存在, c(K+) _____mol/L(如果选择“不存在” ,此问不必做答)
②如果不存在,判断的理由是_____。(如果选择“存在” ,此问不必做答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:请回答下列问题:
(1)A溶液与B溶液反应的离子方程式 .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
(3)请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:
(4)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是: . 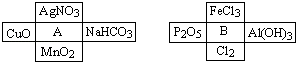
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气制成漂白粉的主要目的是( )
①使它转变成易溶于水的物质 ②使它转变成稳定、便于储存的物质 ③提高氯的质量分数 ④提高漂白能力
A.①②④B.③④C.②③D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.3g钠放入水中,要使每100个水分子中含有1个Na+离子,所需水的质量是( )
A. 184g B. 181.8g C. 180g D. 183.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序:①观察物质的外观性质;②实验并观察现象;③解释现象及得出结论;④预测物质的性质。排序正确的是( )
A.②①③④B.①②③④
C.①④②③D.④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 将氧化钠溶于水中:O2-+H2O=2OH-
C. 纯碱溶液中滴加少量盐酸:CO![]() +H+===HCO
+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,下列说法正确的是( )
A.水的电离程度不变
B.pH值变大
C.稀释过程中,所有离子浓度均变小
D.稀释过程中Kw逐渐变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com