

| 6.0×10-12 |
| 0.06 |
| 1×10-10 |


科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡反应Ba2++SO42-═BaSO4↓ |
| B、氨水与氯化铝溶液反应Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、铁粉与稀盐酸反应Fe+6H+═Fe3++3H2↑ |
| D、氯气通入碘化钾溶液中Cl2+I-═Cl-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| 170℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了探究原电池产生电流的过程,设计了如图所示实验.
某同学为了探究原电池产生电流的过程,设计了如图所示实验.查看答案和解析>>
科目:高中化学 来源: 题型:
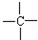 和
和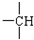 等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含
等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com