
【题目】元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是_______(填元素符号,下同)、非金属性最强的是______,用电子式表示上述两种元素形成化合物的过程___________。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_______________,其氢化物的电子式是___________________________。
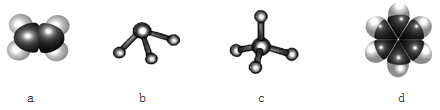
(3)元素①和③可以形成多种化合物。下图模型表示的分子中,可能由①和③形成的是_____________________________________________________(请用结构简式作答)。
(4)元素③、⑤的最高价氧化物对应水化物中酸性较强的是_________(填化学式),说明你判断的理由:____________________________________________________。
(5)主族元素砷(As)的部分信息如图所示。
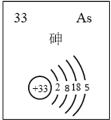
①砷(As)在周期表中的位置是________________。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.⑥的气态氢化物的还原性大于砷的气态氢化物的还原性
【答案】Na Cl ![]()
![]() a为CH2=CH2、c为CH4、d为
a为CH2=CH2、c为CH4、d为 H2CO3 同一主族从上至下,非金属性逐渐减弱,其最高价氧化物对应水化物的酸性逐渐减弱 第四周期第ⅤA族 b
H2CO3 同一主族从上至下,非金属性逐渐减弱,其最高价氧化物对应水化物的酸性逐渐减弱 第四周期第ⅤA族 b
【解析】
由题中各元素在元素周期表中的位置可知,①为H元素,②为B元素,③是C元素,④是Na元素,⑤是Si元素,⑥是P元素,⑦为S元素,⑧是Cl元素,据此分析。
(1)根据元素周期律,同一周期从左至右,金属性逐渐减弱,非金属性逐渐增强;同一主族,从上至下,非金属性逐渐减弱,金属性逐渐增强,可知,元素①~⑧中,金属性最强的是Na,非金属性最强的是Cl,二者形成的NaCl为离子化合物,其形成过程为:![]() 。答案为:Na;Cl;
。答案为:Na;Cl;![]() ;
;
(2)S元素的原子结构示意图为: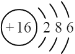 ,其氢化物是H2S,电子式为:
,其氢化物是H2S,电子式为:![]() ,答案为:
,答案为: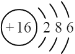 ;
;![]() ;
;
(3)元素①和③分别为H元素、C元素,二者可形成多种有机物,根据C元素和氢元素的成键特点,可知a为CH2=CH2、c为CH4、d为 ;根据b分子中的成键,可知b为NH3。答案为:a为CH2=CH2、c为CH4、d为
;根据b分子中的成键,可知b为NH3。答案为:a为CH2=CH2、c为CH4、d为 ;
;
(4)元素③是C元素,⑤是Si元素,根据同一主族从上至下,非金属性逐渐减弱,其最高价氧化物对应水化物的酸性逐渐减弱,可知,元素③、⑤的最高价氧化物对应水化物的酸性为:H2CO3>H2SiO3。故答案为:H2CO3;同一主族从上至下,非金属性逐渐减弱,其最高价氧化物对应水化物的酸性逐渐减弱;
(5)①分析砷的信息可知,砷的原子结构有4个电子层。最外层有5个电子,根据元素周期表中,电子层数等于周期数,最外层电子数=主族序数,可知,砷在元素周期表中的位置为:第四周期第ⅤA族;答案为:第四周期第ⅤA族;
②a.元素最高正价=最外层电子数=主族序数,可知,砷元素的最高化合价为+5;a项错误;
b.由同一主族元素化学性质相似,可知砷与N元素在同一主族,N有多种氧化物,则As也有多种氧化物,As可以形成+3价氧化物As2O3,也可以形成+5价的氧化物As2O5,b项正确;
c.根据同一主族从上至下非金属性逐渐减弱,氧化性:As<P,则其气态氢化物的还原性:As3H>PH3,c项错误;
答案选b。


科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
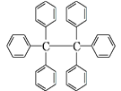
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 它的分子中所有原子共平面
D. 核磁共振氢谱有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应。请回答:
(1)制备乙炔的反应的化学方程式是_______。
(2)该同学的实验方案存在的问题是______。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示。
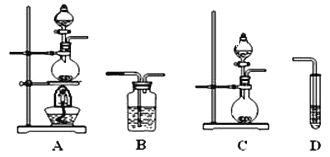
①将装置编号按顺序填在横线上___→B→__________。
②B装置中所盛放的试剂是____________。
(4)乙炔使酸性KMnO4溶液褪色的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:原子序数小于18的同一主族的两种元素X和Y,其原子半径:X<Y。下列说法正确的是
A. 若X和Y均位于VIIA,则键能大小为HX<HY
B. 若X和Y均位于VIA,则H2X分子间易形成氢键
C. 若X和Y均位于IVA,则二者最高价氧化物的晶体类型相同
D. 若X和Y均位于IIA,则第一电离能大小为X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。根据如图回答下列问题:

(1)写出D的结构简式:____________________________。
(2)写出②⑤两步反应的化学方程式,并注明反应类型:
②__________________________________________________(反应类型____________)。
⑤__________________________________________________(反应类型____________)。
(3)利用反应①制备的B中常常还含有少量的A,在实验室中如何除去B中含有的少量杂质A:_________________________________________________(答试剂及操作方法)。
(4)某科研工作者以A为原料成功合成一种分子式为C6H14的物质F,物质F的可能结构有_________种,物质F与B的关系为___________________(选填A、B、C、D)。
A.同一种物质B.互为同分构体C.互为同系物D.互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
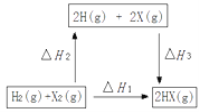
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一环保电池可以消除污染,并产生参与大气循环的物质,装置如图所示。下列说法不正确的是
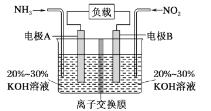
A.电极A极反应式为2NH3-6e-=N2+6H+
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.当有4.48LNO2(标准状况)被处理时,转移电子为0.8mol
D.该电池既能实现有效消除氮氧化物的排放,又能充分利用化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为_______,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为_______。
(2)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________。
(3)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________g·cm-3(精确到小数点后一位数,NA用具体数字代进去计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com