
 CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

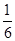 ��2�֣�
��2�֣� ��100%��40%��ʵ��2��CO��ת����Ϊ
��100%��40%��ʵ��2��CO��ת����Ϊ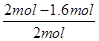 ��100%��20%�����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����������Ӧ���ȡ�
��100%��20%�����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����������Ӧ���ȡ� CO2(g)��H2(g)
CO2(g)��H2(g) ��
��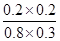 ��0.17��
��0.17��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ϳɰ����������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����N2��H2��ת���� |
| B����1 mol Ba(OH)2��ϡ��Һ�ͺ�1 mol H2SO4��ϡ��Һ��Ӧ�ͷ�����akJ�����ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ��Ӧ����ʽΪ�� OH��(aq)��H��(aq)=H2O(l) ?H =" -a" kJ��mol��1 |
| C����⾫��ͭʱ��ͬһʱ���������ܽ�ͭ����������������ͭ������С |
D������2HI(g)  H2(g)+I2(g)ƽ����ϵ������ƽ����ϵ��ѹǿ��ʹ��ɫ���������������ԭ�����͡� H2(g)+I2(g)ƽ����ϵ������ƽ����ϵ��ѹǿ��ʹ��ɫ���������������ԭ�����͡� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 CO(g)+H2(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� ��(����ĸ)
CO(g)+H2(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� ��(����ĸ) CH4(g)+ H2O (g)
CH4(g)+ H2O (g) HCOOCH3(g) ��H=��29.1 kJ��mol-1
HCOOCH3(g) ��H=��29.1 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ͼ�ٱ�ʾ����ʱ����0.1 mol.L-1����ζ�0.1 mol��L-1NaOH��Һ�����е�pH�仯 |
B��T��ʱ����Ӧ2NO2(g) N2O4(g)�ﵽƽ��ʱNO2��������� N2O4(g)�ﵽƽ��ʱNO2���������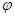 (NO2)��ѹǿP�ı仯��ͼ����ʾ����A�����ɫ�B�����ɫdz (NO2)��ѹǿP�ı仯��ͼ����ʾ����A�����ɫ�B�����ɫdz |
C��ͼ�۱�ʾ����Ⱥ����ܱ�������ͨ��A2��B2��һ��������ʹ��Ӧ2A2(g)��B2(g) 2C(g)���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ����ͼ�ɵó��Ľ�����:��Ӧ������������������������ 2C(g)���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ����ͼ�ɵó��Ľ�����:��Ӧ������������������������ |
D��ͼ���ں��º��ݵ��ܱ������У�����M�������¹�ϵxM(g) Mx(g)��t1ʱ�̣������¶Ȳ���,�ٳ���1 mol M�����´ﵽƽ��ʱ Mx(g)��t1ʱ�̣������¶Ȳ���,�ٳ���1 mol M�����´ﵽƽ��ʱ ������ ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͼ5��ʾ��ѧ��ӦH2(g)+Cl2(g)=2HCl(g)�������仯����÷�Ӧ�ķ�Ӧ�ȡ�H =183kJ��mol-1 |
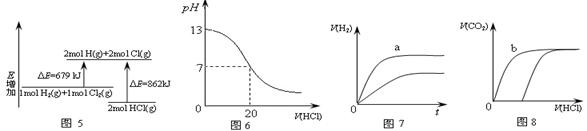
| B��ͼ6��ʾ����ʱ��0.1mol��L-1����ζ�20mL0.1mol��L-1NaOH��Һ����ҺpH�����������仯 |
| C��ͼ7��ʾ�����pH����ͬ��HCl��CH3COOH������Һ�У��ֱ����������п������H2�������ʱ��ı仯����a��ʾCH3COOH��Һ |
| D��ͼ8��ʾ10mL0.1mol/LNa2CO3��NaHCO3������Һ�У��ֱ�μ�0.1mol/LHCl������CO2���������������ı仯����b��ʾNa2CO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��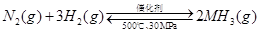 ��H=��38.6kJ��mol-1 ��H=��38.6kJ��mol-1 |
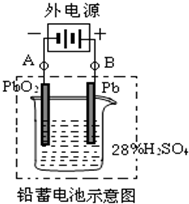
| B��10mL 0.5mol/L CH3COONa��Һ��6mL 1mol/L�����ϣ�c(Cl��)��c(CH3COOH) ��c(Na��)��c(H��)��c(OH��) |
| C��ʵ���û�����(l)������ϩ(l)�ͱ�(l)�ı�ȼ���ȷֱ�Ϊ��3916 kJ/mol����3747 kJ/mol�ͣ�3265 kJ/mol������֤���ڱ������в����ڶ�����̼̼˫�� |
D����25���£���a mol��L-1�İ�ˮ��0.01 mol��L-1������������ϣ���Ӧʱ��Һ��c(NH4+)=c(Cl��)���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb=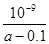 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com