
| ||
| ||
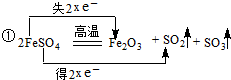 ;
;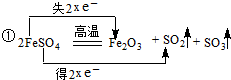 ;
;
| ||


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、“四中子”不显电性 |
| B、第二种粒子是氧元素的另一种同位素 |
| C、“四中子”的质量与一个4He原子质量近似相等 |
| D、第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用电化学原理研究金属铝具有重要的意义.
用电化学原理研究金属铝具有重要的意义.| 3 |
| 2 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
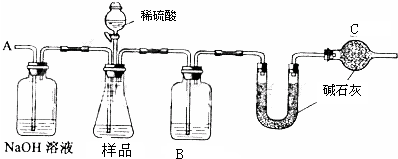
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验探究:甲、乙同学探究KI固体在空气中放置变质的原因.
实验探究:甲、乙同学探究KI固体在空气中放置变质的原因.查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
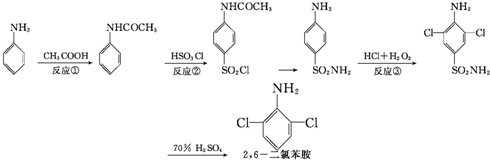
| A、反应①属于取代反应,反应②属于加成反应 |
| B、反应①属于取代反应,反应③属于氧化反应 |
| C、反应①属于取代反应,反应③属于取代反应 |
| D、反应②属于取代反应,反应③属于加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com