
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: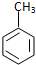 +3HNO3$→_{△}^{浓H_{2}SO_{4}}$ +3HNO3$→_{△}^{浓H_{2}SO_{4}}$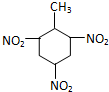 +3H2O +3H2O | |
| D. | 实验室用液溴和苯制溴苯: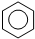 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$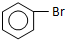 +HBr +HBr |
分析 A.溴乙烷为非电解质,溶液中不存在溴离子;
B.醋酸为弱酸,离子方程式中醋酸不能拆开,应该保留分子式;
C.三硝基甲苯的化学式书写错误;
D.苯与液溴在催化剂作用下反应生成溴苯和溴化氢.
解答 解:A.溴乙烷为非电解质,不能电离出溴离子,该反应不会发生,故A错误;
B.醋酸为弱酸,离子方程式中应该保留分子式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.甲苯与浓硝酸和浓硫酸的混合物反应生成2,4.6-三硝基甲苯,方程式为: ,故C错误;
,故C错误;
D.液溴和苯在催化剂条件下发生反应生成溴苯,方程式为: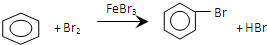 ,故D正确;
,故D正确;
故选D.
点评 本题考查了化学方程式、离子方程式的书写判断,为中等难度的试题,注意掌握化学方程式、离子方程式的书写原则,明确判断化学方程式、离子方程式正误常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 4.0 mol SO2+1.0 mol O2 | |
| C. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(SO42)>c(OH-)>c(H+) | D. | c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外层有7个电子 | D. | 砹易溶于水,难溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
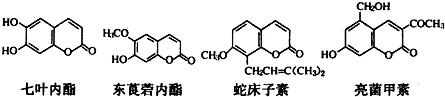
| A. | 七叶内酯与东茛菪内酯互为同系物 | |
| B. | 四种化合物含有的官能团种类完全相同 | |
| C. | l mol上述四种物质与足量氢氧化钠溶液反应,消耗氢氧化钠最多的是亮菌甲素 | |
| D. | 它们都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | Li | Na | K | O | O- | F |
| 电子亲合能/kJ•mol-1 | 59.8 | 52.7 | 48.4 | 141 | -780 | 327.9 |
| A. | 电子亲合能越大,说明越容易得到电子 | |
| B. | 一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量 | |
| C. | 元素的第一电子亲和能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大 | |
| D. | 基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com