
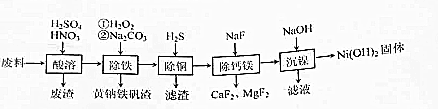
分析 废料与稀硫酸、稀硝酸酸溶反应生成硫酸亚铁、硫酸镍.双氧水具有强氧化性,加入双氧水目的是将Fe2+全部氧化为Fe3+,加入碳酸钠调节pH,除掉铁离子,通入硫化氢除掉铜离子,硫化氢可与铜离子反应生成硫化铜,加入氟化钠,可生成氟化钙、氟化镁沉淀,最后调节pH生成氢氧化镍沉淀.
(1)镍能将硝酸还原为氮气;
(2)双氧水具有氧化性;铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀;黄钠铁矾[NaxFey(SO4)m(OH)n]中铁元素化合价为+3价,元素化合价代数和为0,x+3y-2m-n=0;
(3)硫化氢与铜离子反应生成硫化铜沉淀;Na2S2O3与铜离子反应生成硫代硫酸铜沉淀;
(4)氟离子水解生成氟化氢;
(5)根据Ni(OH)2中镍的质量分数求出镍的质量,然后计算回收率;
(6)电池放电过程中,正极上NiOOH得电子生成Ni(OH)2.
解答 解:(1)金属镍溶解的离子方程式5Ni+12H++2NO3-=5Ni2++2N2↑+6H2O,故答案为:5Ni+12H++2NO3-=5Ni2++2N2↑+6H2O;
(2)双氧水具有强氧化性,加入双氧水目的是将Fe2+全部氧化为Fe3+;铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,不变蓝,说明H2O2已足量;黄钠铁矾[NaxFey(SO4)m(OH)n]中铁元素化合价为+3价,元素化合价代数和为0,x+3y-2m-n=0,1+3×3-2×2-n=0,n=6,故答案为:将Fe2+氧化为Fe3+;铁氰化钾;6;
(3)硫化氢与铜离子反应生成硫化铜沉淀:H2S+Cu2+=CuS+2H+;Na2S2O3与铜离子反应生成硫代硫酸铜沉淀,用Na2S2O3代替H2S除铜,反应更充分,除铜效果更好,故答案为:H2S+Cu2+=CuS+2H+;反应更充分,除铜效果更好;
(4)氟离子水解生成氟化氢,腐蚀陶瓷容器,故答案为:氟离子水解生成氟化氢,腐蚀陶瓷容器;
(5)$\frac{\frac{59}{93}×31}{100×0.21}$=93.65%,故答案为:93.65%;
(6)电池放电过程中,正极上NiOOH得电子生成Ni(OH)2,则正极的电极方程式为:NiOOH+H2O+e--=Ni(OH)2+OH-,故答案为:NiOOH+H2O+e--=Ni(OH)2+OH-.
点评 本题以工艺流程为基础,考查了工艺流程解题思路和基本方法,实验基本操作,元素化合物性质等相关知识,掌握基础是关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸 | B. | 0.01mol/L盐酸 | C. | 0.1mol/L醋酸 | D. | 0.01mol/L醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
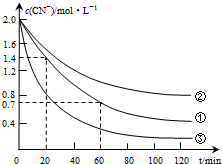
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
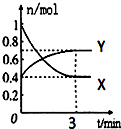 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com