
 2015��8��12�������ش�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע���ݲ�Σ���ֿ��д��д������ơ��ء����ף�P4��������狀��軯�ƣ�NaCN����
2015��8��12�������ش�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע���ݲ�Σ���ֿ��д��д������ơ��ء����ף�P4��������狀��軯�ƣ�NaCN�������� ��1��Ԫ�ػ��ϼ����߷���������Ӧ�õ������������PԪ�ػ��ϼ۱仯����ת�Ƶ������ʵ�����
��2�����ɵ���ƽ�ⳣ����֪�����ԣ�H2CO3��HCN��HCO3-����NaCN��Һͨ������CO2����NaHCO3��HCN��
�ڳ����£��軯���������������Һ��Ӧ������̼�����ƺ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ��������ƽ��д����ʽ��
�۵�������������ԭ��Ӧ��NOx��������õ�������N2��O2-��
��3������֪����.2NH3��g��+CO2��g���TNH2CO2NH4��s����H=-159.47kJ•mol-1
��NH2CO2NH4��s���TCO��NH2��2��s��+H2O��g����H=+72.49kJ•mol-1
���ݸ�˹���ɣ���+��ɵã�2NH3��g��+CO2��g���TCO��NH2����s��+H2O��g����
�����ۼ��뵽100mLijŨ�ȵ�ϡ�����У���ַ�Ӧ��������ʣ��m1g���ۣ�����Fe��NO3��2��NO����0.02mol�����ݵ���ת���غ����μӷ�Ӧ��Fe�����ʵ������ٸ���Feԭ���غ������Һ��n[Fe��NO3��2]��������Һ������ϡ���������ٷ�ӦΪֹ������ʣ��Fe��m2g��Fe��NO3��2��NO3-������Ӧ3Fe+8H++2NO3-�T3Fe2++2NO��+4H2O����m1-m2��Ϊ����Һ��NO3-��Ӧ��Fe��������
��� �⣺��1����Ӧ��PԪ�ػ��ϼ����ߵõ�H3PO4����������ΪH3PO4������1mol P4�μӷ�Ӧת�Ƶ���Ϊ1mol��4��5=20mol���ʴ�Ϊ��H3PO4��20��
��2�����ɵ���ƽ�ⳣ����֪�����ԣ�H2CO3��HCN��HCO3-����NaCN��Һͨ������CO2����NaHCO3��HCN����Ӧ����ʽΪ��CO2+NaCN+H2O=NaHCO3+HCN��
�ʴ�Ϊ��CO2+NaCN+H2O=NaHCO3+HCN��
�ڳ����£��軯���������������Һ��Ӧ������̼�����ƺ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ��������Ӧ����ʽΪ��NaCN+H2O2+H2O=NaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O=NaHCO3+NH3����
�۵�������������ԭ��Ӧ��NOx��������õ�������N2��O2-�������缫��ӦʽΪ��2NOx+4xe-=N2+2xO2-��
�ʴ�Ϊ��2NOx+4xe-=N2+2xO2-��
��3������֪����.2NH3��g��+CO2��g���TNH2CO2NH4��s����H=-159.47kJ•mol-1
��NH2CO2NH4��s���TCO��NH2��2��s��+H2O��g����H=+72.49kJ•mol-1
���ݸ�˹���ɣ���+��ɵã�2NH3��g��+CO2��g���TCO��NH2����s��+H2O��g������H=-159.47kJ•mol-1+72.49kJ•mol-1=-86.98kJ•mol-1��
�ʴ�Ϊ��-86.98��
�����ۼ��뵽100mLijŨ�ȵ�ϡ�����У���ַ�Ӧ��������ʣ��m1g���ۣ�����Fe��NO3��2��NO���壬NO�����ʵ���Ϊ$\frac{0.448L}{22.4L/mol}$=0.02mol�����ݵ���ת���غ��֪���μӷ�Ӧ��Fe�����ʵ���Ϊ$\frac{0.02mol����5-2��}{2}$=0.03mol������Feԭ���غ��֪����Һ��n[Fe��NO3��2]=0.03mol����Һ��n��NO3-��=0.06mol��
������Һ������ϡ���������ٷ�ӦΪֹ��Fe��NO3��2��NO3-������Ӧ3Fe+8H++2NO3-�T3Fe2++2NO��+4H2O������ʣ��ͭ��m2g����m1-m2��Ϊ����Һ��NO3-��Ӧ��ͭ�����������ٴη�Ӧ��ͭ�����ʵ���Ϊxmol����
3Fe+8H++2NO3-�T3Fe2++2NO��+4H2O
3 2
xmol 0.06mol
����x=0.09mol
�����ٴη�Ӧ��Fe������Ϊ0.09mol��56g/mol=5.04g������m1-m2��=5.04g��
�ʴ�Ϊ��5.04��
���� ���⿼��������ԭ��Ӧ������������㡢��ѧ����ʽ��д�����ԭ������Ӧ�ȼ���ȣ���3���йؼ����жϣ�m1-m2��Ϊ����Һ��NO3-��Ӧ��Fe��������ע����ݵ���ת���غ㡢Ԫ���غ���㣬����ݷ���ʽ���㣬��ԱȽ��鷳��ע���غ�˼����������ԭ��Ӧ������Ӧ�ã������������ȫ��Ӧ���������ӷ���ʽ���㣮


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| Ũ��/��mol/L�� | 2��10-3 | 1��10-3 | 1��10-2 | 2��10-3 |
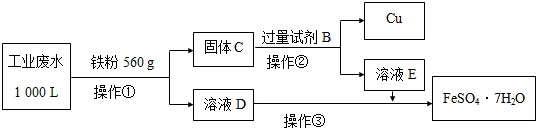
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22.2% | B�� | 30.0% | C�� | 75.7% | D�� | 80.6% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 18g������ຬ���������ĿΪ4NA | |
| B�� | 0.1L3mol•L-1��NH4NO3��Һ�к��е�NH4+��ĿΪ0.3NA | |
| C�� | 7.8gNa2O2����������������Ϊ0.4NA | |
| D�� | 4.5gSiO2�����к��еĹ�������ĿΪ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | ���� | ���� |
| A | KI������Һ�е�����ˮ����ͨ��SO2 | �ȱ���ɫ����ɫ | SO2��Ư���� |
| B | �ýྻ��˿պȡ��ɫ��Һ������ɫ��Ӧ | ����ʻ�ɫ | ��ɫ��ҺΪ������Һ |
| C | ���ɫZnS�����ϵμ�0.1mol/LCuSO4��Һ | ������Ϊ��ɫ | Ksp��ZnS����Ksp��CuS�� |
| D | �����½�AlƬ����Ũ������ | �����Ա仯 | Al��Ũ�����Ӧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������θ������ҩ�� | |
| B�� | �������������ڳ��������桢����Ũ���� | |
| C�� | �������������������ά��ʯӢ���� | |
| D�� | �������ƿ�����Ư���ͺ�������еĹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
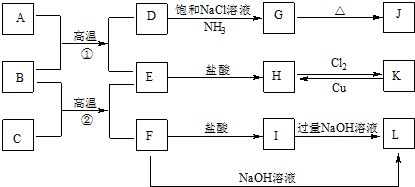
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na3PO4�T3Na++P5++4O2- | B�� | H2SO4�TH++SO42- | ||
| C�� | NH3•H2O?NH4++O2-+H+ | D�� | NH4NO3�TNH4++NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na | B�� | Mg | C�� | Al | D�� | һ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com