
| A. | 以淀粉为原料可制取乙酸乙酯 | B. | 聚氯乙烯分子中含碳碳双键 | ||
| C. | 丁烷有3种同分异构体 | D. | 油脂的皂化反应属于加成反应 |
分析 A.淀粉水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇,乙醇氧化生成乙酸,乙醇与乙酸发生酯化反应生成乙酸乙酯;
B.聚氯乙烯分子为加聚产物,分子中含单键;
C.丁烷存在正丁烷、异丁烷两种结构;
D.油脂在碱性条件下水解反应为皂化反应.
解答 解:A.淀粉水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇,乙醇氧化生成乙酸,乙醇与乙酸发生酯化反应生成乙酸乙酯,则以淀粉为原料可制取乙酸乙酯,故A正确;
B.聚氯乙烯分子为加聚产物,分子中含单键,不存在碳碳双键,故B错误;
C.丁烷存在正丁烷、异丁烷两种结构,共2种同分异构体,故C错误;
D.油脂在碱性条件下水解反应为皂化反应,属于取代反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物的结构,题目难度不大.


科目:高中化学 来源: 题型:选择题
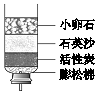
| A. | 净水过程中发生了化学变化 | B. | 该净水器能杀菌消毒 | ||
| C. | 活性炭的主要作用是吸附杂质 | D. | 净化后的水属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
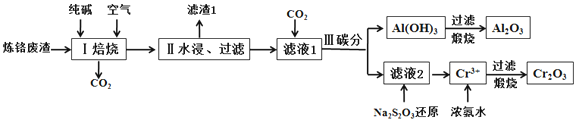
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
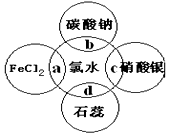 氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)
氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
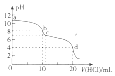 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com