
| A. | 0.4Q1+0.05Q2 | B. | 0.4Q1+0.05Q3 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量.
解答 解:标准状况下11.2L甲烷和氢气混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol,
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-Q1 kJ•mol-1 可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1 kJ•mol-1=0.4Q1 kJ,
由2H2(g)+O2(g)→2H2O(l)+Q3
可知,
0.1mol氢气燃烧放出的热量为$\frac{0.1mol}{2}×{Q}_{3}$Q3kJ•mol-1=0.05Q3kJ,
所以放出的热量为0.4Q1kJ+0.05Q3kJ=(0.4Q1+0.05Q3)kJ,
故选:B.
点评 本题考查根据热化学方程式进行的有关反应热的计算,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
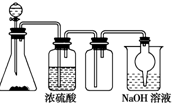 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和较浓H2SO4 | ||
| C. | Cu片和浓HNO3 | D. | 浓氨水和生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是金属元素 | |
| B. | 一定能和氢氧化钠溶液反应生成氢气 | |
| C. | 一定是ⅡA族元素 | |
| D. | 可能是金属元素,也可能不是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com