
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烯 | D. | 混合气体中一定有乙炔 |
分析 生成水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,然后根据平均分子式判断.
解答 解:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,混合烃的平均分子式为C1.6H4;
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,故A正确;
B.混合气体中一定含有CH4,不能确定是否含有C2H4,故B错误;
C.混合气体中一定含有CH4,可能含有C2H4或C3H4,故C错误;
D.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故D错误;
故选A.
点评 本题考查混合烃组成的判断,为高频考点,侧重学生的分析、计算能力的考查,题目难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.


科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
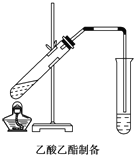 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率关系是:3υ(NH3)═2υ(H2O) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 达到化学平衡时,5υ正(O2)=4υ逆(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 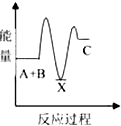 | B. | 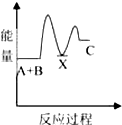 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能够燃烧 | |
| B. | 乙醇(一定量)与足量金属钠反应放出氢气的量 | |
| C. | 乙醇的分子式是C2H6O | |
| D. | 乙醇的沸点比水的低、密度比水的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com