
| ||
| ||


科目:高中化学 来源: 题型:
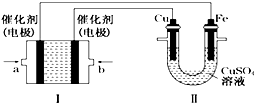 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
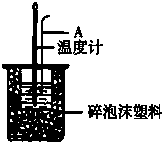 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
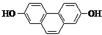 的有机物,在核磁共振氢谱上吸收峰的面积之比为
的有机物,在核磁共振氢谱上吸收峰的面积之比为查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中可以得到NaCl,电解熔融NaCl 可制备Cl2和Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| D、利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中少量的乙烯:通过酸性KMnO4溶液进行分离 |
| B、除去溴苯中少量的溴,可用苯进行洗涤、分液 |
| C、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液,然后干燥、蒸馏 |
| D、除去氯气中少量的氯化氢,通过NaOH溶液进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”禁止食用,但可用来制造肥皂 |
| B、煤经过气化或液化处理,可获得清洁能源等 |
| C、塑料、聚酯纤维和光导纤维都属有机高分子材料 |
| D、开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com