
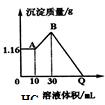
 把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)分析 NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,向所得的浊液中逐滴加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,1.16g沉淀为Mg(OH)2;
10-30mL时,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠、硫酸钠,沉淀为Mg(OH)2、Al(OH)3;
30-QmL过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁.
(1)根据Mg元素守恒n(MgSO4)=n[Mg(OH)2];生成氢氧化铝消耗20mL盐酸,结合方程式计算氢氧化铝的物质的量,根据Al元素守恒n[Al2(SO4)3]=$\frac{1}{2}$n[Al(OH)3];
B点溶质为NaCl、Na2SO4,消耗盐酸30mL,根据钠离子可得n(NaOH)=n(NaCl)+2n(Na2SO4)=n(NaCl)+2n(MgSO4)+6n[Al2(SO4)3];
(2)整个过程中,Q点加入盐酸实际中和原混合物中NaOH,则n(HCl)=n(NaOH),进而计算Q点盐酸体积.
解答 解:NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,向所得的浊液中逐滴加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,1.16g沉淀为Mg(OH)2;
10-30mL时,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠、硫酸钠,沉淀为Mg(OH)2、Al(OH)3;
30-QmL过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁.
(1)=根据Mg元素守恒n(MgSO4)=n[Mg(OH)2]=$\frac{1.16g}{56g/mol}$=0.02mol;
生成氢氧化铝消耗20mL盐酸,消耗HCl为0.02L×2mol/L=0.04mol,由H2O+AlO2-+H+=Al(OH)3↓可知,生成氢氧化铝为0.04mol,根据Al元素守恒n[Al2(SO4)3]=$\frac{1}{2}$n[Al(OH)3]=0.02mol;
B点溶质为NaCl、Na2SO4,消耗盐酸30mL,根据钠离子可得n(NaOH)=n(NaCl)+2n(Na2SO4)=n(NaCl)+2n(MgSO4)+6n[Al2(SO4)3]=0.03L×2mol/L+0.02mol×2+0.02mol×6=0.22mol,
答:原混合物中的NaOH、MgSO4、Al2(SO4)3 的物质的量分别为0.22mol、0.02mol、0.02mol;
(2)整个过程中,Q点加入盐酸实际中和原混合物中NaOH,则n(HCl)=n(NaOH)=0.22mol,故Q点盐酸体积为$\frac{0.22mol}{2mol/L}$=0.11L,即为110mL,
答:Q点盐酸体积为110mL.
点评 本题考查混合物计算,关键是明确给图象中各阶段发生的反应,知道拐点代表的含义及溶液中溶质的成分,再利用守恒法计算解答,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
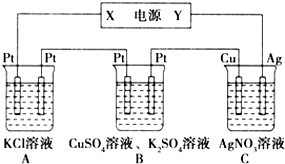 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com