
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
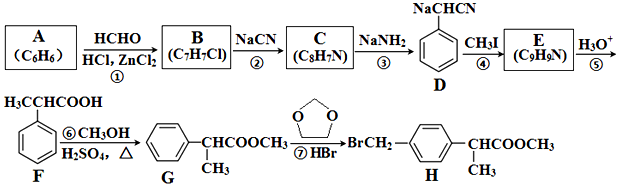
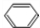 +HCHO+HCl $\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl $\stackrel{ZnCl_{2}}{→}$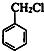 +H2O;反应⑥的化学方程式为
+H2O;反应⑥的化学方程式为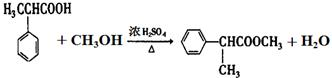 .
.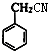 ;E的结构简式为
;E的结构简式为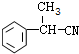 .
. .
.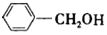 合成
合成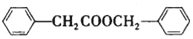 的合成
的合成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
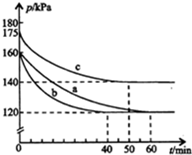 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
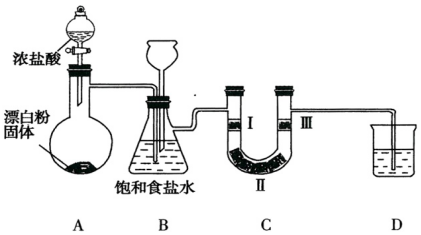
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com