
| A. | Na和O2 | B. | Fe和FeCl3 | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
分析 A.钠和氧气反应生成氧化钠,钠在空气中燃烧生成过氧化钠;
B.无论FeCl3溶液是否过量,铁和FeCl3溶液反应都生成氯化亚铁;
C.少量盐酸和碳酸钠溶液反应生成碳酸氢钠,过量盐酸和碳酸钠溶液反应生成二氧化碳;
D.氯化铝和少量氢氧化钠反应生成氢氧化铝沉淀,和过量氢氧化钠反应生成偏铝酸钠.
解答 解:A.Na和O2在不加热时生成Na2O,4Na+O2=2Na2O,加热时生成Na2O2,2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,反应条件不同,生成物不同,故A错误;
B.无论FeCl3溶液是否过量,铁和FeCl3溶液反应都生成氯化亚铁,2Fe3++Fe=3Fe2+,故B正确;
C.少量盐酸和碳酸钠溶液反应生成碳酸氢钠,CO32-+H+=HCO3-,过量盐酸和碳酸钠溶液反应生成二氧化碳,CO32-+2H+=CO2↑+H2O,量不同,生成物不同,故C错误;
D.少量氢氧化钠和氯化铝反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,过量氢氧化钠和氯化铝反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,反应物用量不同,产物不同,故D错误;
故选B.
点评 本题考查了物质间的反应,明确物质的性质是解本题关键,反应物相同,如果反应条件不同、反应物浓度不同、反应物用量不同都会导致产物不同,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,A的浓度是原来的0.45倍,则a+b>c+d | |
| B. | 若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为b:a | |
| C. | 若平衡体系中共有气体n mol,再向其中充入bmolB,达到平衡时气体总物质的量为n+bmol,则a+b=c+d | |
| D. | 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
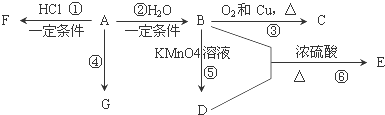
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
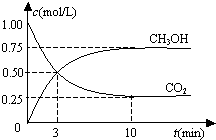
| A. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| B. | 从反应开始到平衡,氢气的转化率为75% | |
| C. | 该密闭容器的体积为1L | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
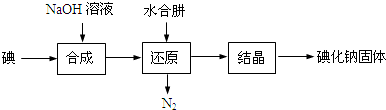
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
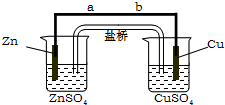 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com