
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.碘、干冰都是分子晶体,升华均克服分子间作用力,故A正确;
B.氯化钠为离子晶体,熔化克服离子键,冰为分子晶体,熔化克服分子间作用力,故B错误;
C.二氧化硅为原子晶体,氧化钠为离子晶体,熔化所克服的粒子间的相互作用分别为共价键、离子键,故C错误;
D.食盐是离子晶体,蔗糖是分子晶体,克服作用力分别为离子键、分子间作用力,故D错误.
故选A.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
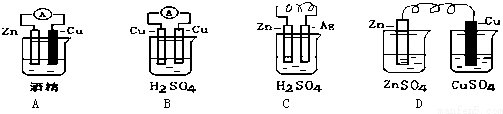
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
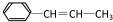 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 可以发生加成、取代、氧化反应 | |
| B. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| C. | 能发生加聚反应,其生成物可用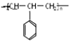 来表示 来表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成2mol Na2Mn5O10转移4mol电子 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: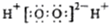 | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | C2H4与C3H6一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com