
【题目】(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3 + 3C+S![]() A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_________。
②在生成物中,A的电子式________,含极性共价键的分子的中心原子轨道杂化类型为_____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为________,Q2+的未成对电子数是__________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为_______。
【答案】 O>N>C>K 离子晶体 sp 1:1 3d84s2 4 [CrCl(H2O)5]2+
【解析】(1)①同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,正确答案:O>N>C>K。
②含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,由原子守恒可知,物质A为K2S,属于离子晶体,正确答案:离子晶体;sp。
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1;正确答案:1:1。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子;正确答案:3d84s2;4。
(3)中和生成的氢离子需浓度为0.12 mol·L-1氢氧化钠溶液25.00 ml ,由H++OH-=H2O,可以得出H+的物质的量为0.12×25×10-3=0.003mol,所以![]() ,[CrCln(H2O)6-n]x+(中Cr的化合价为+3价,则有3-n=2,计算得出n=1,即该配离子的化学式为[CrCl(H2O)5]2+;正确答案:[CrCl(H2O)5]2+。
,[CrCln(H2O)6-n]x+(中Cr的化合价为+3价,则有3-n=2,计算得出n=1,即该配离子的化学式为[CrCl(H2O)5]2+;正确答案:[CrCl(H2O)5]2+。


科目:高中化学 来源: 题型:
【题目】今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH4+、Fe2+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)该混合物中一定含有的离子__________;可能含有的离子__________。
(3)K+物质的量: n(K+)_____(具体值或取值范围)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:
Ⅰ.CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=________;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将________(填“增大”、“不变”或“减小”),原因为____________________________________________________。
(2)一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
①△H3=________。
②5min内该反应的反应速率v(CH4)=________。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4,平衡后容器内CH4的体积分数为________。
(3)将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
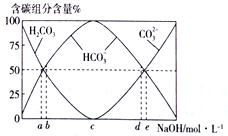
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是________(选填“a”、“b”、“c”、“d”或“e” ),
(4)以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池的下列说法中,正确的是
A. 在负极上发生氧化反应 B. 化学性质较活泼的金属为负极
C. 在外电路上电子由负极流向正极 D. 是由电能转化为化学能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知物质A~K之间有如下图所示转化关系。其中A是一种易溶于水的离子化合物,在空气中易潮解和变质,在水中可以电离出电子总数相等的两种离子;E为生活中常用消毒剂的有效成分,F是生活中不可缺少的调味剂,G为无色液体,B、C、D、K都是单质;反应②~⑤都是重要的工业反应。(部分反应需要在溶液中进行)

(1)物质D中所含元素在周期表中的位置为____________________________,
E中所含化学键类型有___________________________________________,
M的结构式为___________________________________________________。
(2)反应④的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格利雅试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,它可与羰基发生加成反应,如: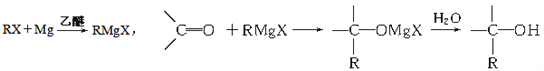
今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是
A. 氯乙烷和甲醛 B. 氯乙烷和丙醛
C. 一氯甲烷和丙酮 D. 一氯甲烷和乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com