
| A.离子晶体的构成微粒是离子 | B.原子晶体的熔沸点一般很高 |
| C.金属晶体的熔沸点均很高 | D.稀有气体的原子能形成分子晶体 |
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源:不详 题型:单选题
| A.F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.金刚石的硬度、熔点、沸点都高于晶体硅 |
| D.NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子晶体中一定存在共价键 |
| B.第ⅦA族氢化物随相对分子质量增加,熔沸点逐渐升高,HF沸点最低 |
| C.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏 |
| D.熔融状态下导电的晶体一定是金属晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧元素和铝组成的晶体中有的是原子晶体 |
| B.已给出的物质中只有BCl3和CO2是分子晶体 |
| C.同族元素的氧化物可以形成不同类型的晶体 |
| D.不同族元素的氧化物可以形成相同类型的晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 熔点(℃) | 801 | 714 | 190 | —70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
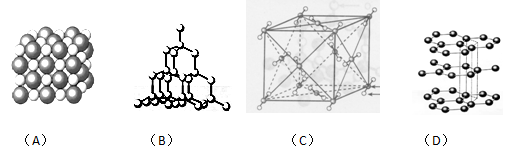
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体 | B.原子晶体 | C.分子晶体 | D.金属晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有金属阳离子的晶体一定是离子晶体 |
| B.原子晶体中,粒子之间只有一种作用力,即共价键 |
| C.分子晶体中,粒子之间均有两种作用力,即范德华力和共价键 |
| D.金属晶体的性质,都可以用电子气理论来解释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
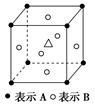
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com