
| A. | 14C与14N | B. | D2与H2 | C. | O2与O3 | D. | 35Cl与37Cl |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
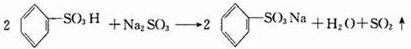 、③
、③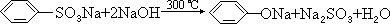 、④
、④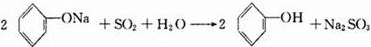 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | R分子有3种含氧官能团 | B. | 1molR最多消耗5mol NaOH | ||
| C. | R与氯化铁溶液发生显色反应 | D. | R能发生取代、加成、氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的价电子排布为ns2np1~6的元素一定是主族元素 | |
| B. | 基态原子的p能级上有5个电子的元素一定是ⅦA族元素 | |
| C. | 原子的价电子排布为(n-1)d6~8ns2的元素一定位于ⅢB~ⅦB族 | |
| D. | 基态原子的N层上只有1个电子的元素一定是主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
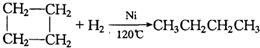
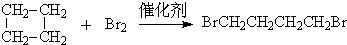 、
、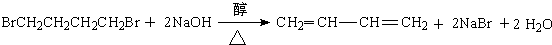 .
.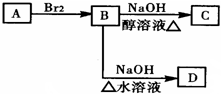
 ;C
;C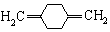 .
.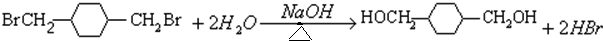 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
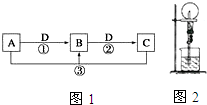 已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).
已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
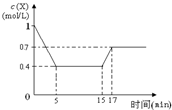 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑦ | B. | 只有①⑦ | C. | 只有⑦ | D. | 只有①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com