
分析 ①Na和H2O的反应生成氢氧化钠和氢气;
②Na2O2和H2O的反应生成氢氧化钠和氧气;
③NaH和水的反应生成氢氧化钠和氢气;
④将NaOH与CO2按物质的量之比3:2充分反应,反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3;
⑤向Na2CO3溶液中通入过量CO2得到碳酸氢钠;
⑥将Na2CO3溶液与石灰乳混合发生反应得到碳酸钙和氢氧化钠溶液;
⑦将NaHCO3溶液与少量澄清石灰水混合会发生反应生成碳酸钙、水以及氢氧化钠溶液;
⑧Al和NaOH溶液的反应得到偏铝酸钠和氢气;
⑨Mg和稀硝酸溶液的反应生成硝酸镁、水以及一氧化氮;
⑩将AlCl3溶液与NaHCO3溶液混合,碳酸氢根和铝离子之间会发生双水解反应生成氢氧化铝和二氧化碳气体.
解答 解:①Na和H2O的反应生成氢氧化钠和氢气,即2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
②Na2O2和H2O的反应生成氢氧化钠和氧气,即2Na2O2+2H2O=2Na++2OH-+O2↑;
故答案为:2Na2O2+2H2O=2Na++2OH-+O2↑;
③NaH和水的反应生成氢氧化钠和氢气,即H-+H2O=OH-+H2↑;
故答案为:H-+H2O=OH-+H2↑;
④将NaOH与CO2按物质的量之比3:2充分反应,反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3,即3OH-+2CO2=HCO3-+CO32-+H2O,故答案为:3OH-+2CO2=HCO3-+CO32-+H2O;
⑤向Na2CO3溶液中通入过量CO2得到碳酸氢钠,即CO32-+H2O+CO2=HCO3-;故答案为:CO32-+H2O+CO2=HCO3-;
⑥将Na2CO3溶液与石灰乳混合发生反应得到碳酸钙和氢氧化钠溶液,实质是碳酸根离子和钙离子之间的复分解反应,即CO32-+Ca2+=CaCO3↓;
故答案为:CO32-+Ca2+=CaCO3↓;
⑦将NaHCO3溶液与少量澄清石灰水混合会发生反应生成碳酸钙、水以及氢氧化钠溶液,离子反应为2HCO3-+20H-+Ca2+═CaCO3↓+2H2O+CO32-,故答案为:2HCO3-+20H-+Ca2+═CaCO3↓+2H2O+CO32-;
⑧Al和NaOH溶液的反应得到偏铝酸钠和氢气,即2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
⑨Mg和稀硝酸溶液的反应生成硝酸镁、水以及一氧化氮,即3Mg+8H++2NO3-=3Cu2++2NO↑+4H2O;故答案为:3Mg+8H++2NO3-=3Cu2++2NO↑+4H2O;
⑩将AlCl3溶液与NaHCO3溶液混合,碳酸氢根和铝离子之间会发生双水解反应生成氢氧化铝和二氧化碳气体,即3HCO3-+Al3+=3CO2↑+Al(OH)3↓,
故答案为:3HCO3-+Al3+=3CO2↑+Al(OH)3↓.
点评 本题考查学生物质的性质以及离子方程式的书写知识,属于综合知识的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列做法中不符合“绿色化学”思想的是
A.以水性涂料代替油性涂料
B.以无磷洗涤剂代替含磷洗涤剂
C.试验后的有毒有害物质应分类收集,统一处理
D.在通风橱中制取氯气时不用NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
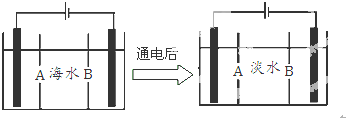
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
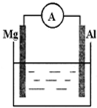 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z |
| 相关 信息 | 食盐中存在的 金属元素 | 其一种单质是天然 存在的最硬的物质 | 地壳中含量 最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51 | B. | 95 | C. | 146 | D. | 241 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯化铁溶液溶解铜 Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 氯气溶于水 Cl2+H2O═2H++Cl-+ClO- | |
| D. | 氢氧化钠溶液吸收二氧化硫气体 SO2+2OH-═SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH和Na2CO3与CH3COOH和NaHCO3 | |
| B. | AgNO3和HCl与AgNO3和NaCl | |
| C. | BaCl2和Na2SO4 与Ba(OH)2和H2SO4 | |
| D. | KOH和AlCl3与氨水和AlBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | Na2O2与足量的水反应生成1 mol O2,转移电子数目为2NA | |
| C. | 某密闭容器中有2 mol SO2和1 mol O2,在一定条件下充分反应,转移的电子数为4NA | |
| D. | 18 g重水(D2O)所含的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com