
(4分)( 1)为了检验和除去下表中的各种杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
|
物 质 |
检验试剂 |
除杂试剂 |
|
甲烷(乙烯) |
|
|
|
酒 精(水) |
|
|
(I)检验的试剂: A.无水硫酸铜 B.酸性高锰酸钾溶液 C.盐酸 D.氢氧化钠溶液 ( II)除杂试剂:a.硫酸 b.酸性高锰酸钾溶液 c.新制的生石灰 d.溴水
科目:高中化学 来源: 题型:



 或
或  ,为验证其结构,取少量该液体,加入少量酸性高锰酸钾溶液,振荡,静置.若结构为
,为验证其结构,取少量该液体,加入少量酸性高锰酸钾溶液,振荡,静置.若结构为  ,其现象为
,其现象为 ,其现象为
,其现象为查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).查看答案和解析>>
科目:高中化学 来源: 题型:
| aNa |
| 58.5 |
| b |
| 58.5 |
| b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
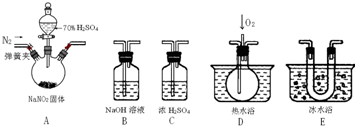
查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
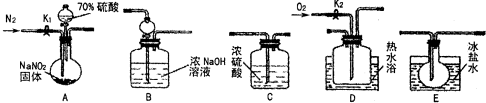
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com