
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
Ⅰ.Cl2的制备。
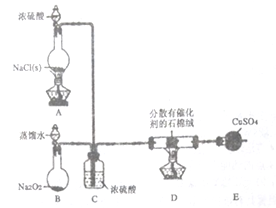
(1)装置B中发生反应的化学方程式为________________。
(2)装置C的作用除干燥气体外还有______________________。
(3)装置E中盛放CuSO4的仪器名称为___________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为________________。
Ⅱ.Cl2性质的验证。
该小组用实验Ⅰ中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
查阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物,同时,溶解度大的气体难逸出;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
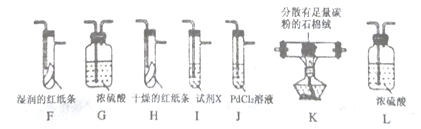
(4)按气流从左到右的方向,装置连接的合理顺序为
E→G→K→ → → → → →尾气处理(填装置字母)。_________
(5)试剂X的名称为_______________。
(6)装置J中发生反应的化学方程式为______________。
(7)设计实验证明经净化后的Cl2中不含HCl:________________。
【答案】2Na2O2+2H2O=4NaOH+O2 控制气体的流速和比例、使气体混合均匀 (球形)干燥管 4HC1+O2![]() 2H2O+ 2C12 JLHFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HC1
2H2O+ 2C12 JLHFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HC1
【解析】
试题Ⅰ.(1)装置B中过氧化钠与水反应放出氧气;(2)根据装置C中的气泡可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)根据装置图回答;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气;Ⅱ.E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl。(7)氯气易溶于CCl4、HC1不溶于CCl4,气体通过CCl4后,再通入AgNO3溶液,若无白色沉淀生成,则证明净化后的Cl2中不含HC1。
解析:Ⅰ.(1)装置B中过氧化钠与水反应放出氧气,反应方程式是2Na2O2+2H2O=4NaOH+O2![]() ;(2)根据装置C中气泡溢出的速度可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)装置E是球形干燥管;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气,反应方程式是4HC1+O2
;(2)根据装置C中气泡溢出的速度可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)装置E是球形干燥管;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气,反应方程式是4HC1+O2![]() 2H2O+ 2C12;Ⅱ. E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥除水,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S,所以装置连接的合理顺序为E→G→K→J→L→H→F→I→尾气处理;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S,所以X的名称为硫化钠溶液;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl,反应方程式是PdCl2+CO+H2O=Pd+CO2+2HCl。(7)将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成,则证明净化后的Cl2中不含HC1。
2H2O+ 2C12;Ⅱ. E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥除水,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S,所以装置连接的合理顺序为E→G→K→J→L→H→F→I→尾气处理;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S,所以X的名称为硫化钠溶液;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl,反应方程式是PdCl2+CO+H2O=Pd+CO2+2HCl。(7)将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成,则证明净化后的Cl2中不含HC1。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的容器加入一定量的A(s)发生反应:3A(s) ![]() B(g) +2C(g),下列描述中能说明该反应达到平衡的是
B(g) +2C(g),下列描述中能说明该反应达到平衡的是
① v(B)逆=2 v(C)正 ②单位时间内生成 a mol B,同时消耗 2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤B的体积分数不再变化 ⑥混合气体的平均相对分子质量不再变化
A. ①②③B. ②③④C. ④⑤D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①钠离子[Na]+ ②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]()
④氧原子![]() ⑤氢离子H+ ⑥铵根离子
⑤氢离子H+ ⑥铵根离子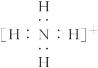
⑦铝原子Al ⑧溴离子![]()
A. ②③④⑥⑦B. ①③④⑥⑦⑧
C. ③④⑤⑥⑧D. ②③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
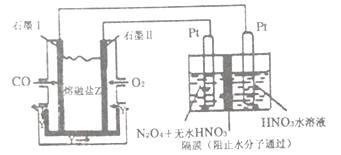
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO 对大气的污染,某研究性学习小组拟研究CO和H2O 反应转化为绿色能源H2。己如:
2CO(g)+O2(g)=2CO2(g); △H= -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
H2O(g)=H2O(l) △H= -44.0kJ·moL-1
(1)氢气燃烧热△H=_____________________。
(2)写出CO 和H2O(g)作用生成CO2 和H2的热化学方程式______________________。
(3)往1L 体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为____________;反应达到平衡后,升高温度,此时平衡常数将____________(填“变大”、“ 不变”或“变 小”)。
(4)从汽车尾气中分离出CO 与O2、与熔融盐Na2CO3组成燃料电池,同时采用电解法制备N2O5,装置如下图所示,其中Y为CO2。写出石墨Ⅰ电极上发生反应的电极反应式________________。在电解池中生成N2O5的电极反应式为______________________。
(5)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
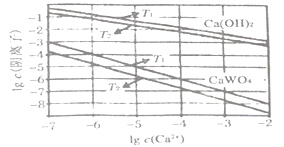
T1___________T2 (填“>”或“<”),T1时Ksp (CaWO4)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为LixC+Li1-xCoO2![]() C+LiCoO2,锂硫电池的总反应为2Li+S
C+LiCoO2,锂硫电池的总反应为2Li+S![]() Li2S。有关两种电池说法正确的是 ( )
Li2S。有关两种电池说法正确的是 ( )
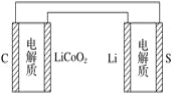
A. 锂离子电池放电时,Li+向负极迁移
B. 当锂硫电池充电时,硫电极发生氧化反应
C. 理论上两种电池的电极材料单位质量相同时释放的电能相同
D. 上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是
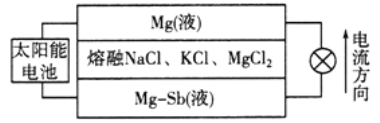
A. 放电时,Mg(液)层的质量减小
B. 放电时,正极反应为:Mg2++2e===Mg
C. 该电池充电时,Mg—Sb(液)层的质量增大
D. 该电池充电时,C1向下层方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
X | 其简单离子在第3周期元素的简单离子中半径最小 |
Y | 其最简单氢化物丙的水溶液呈碱性 |
Z | 原子核外电子数和周期序数相等 |
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种火箭发动机的高能燃料,一个分子中含有18个电子,其组成元素与丙相同,戊是两性氢氧化物。
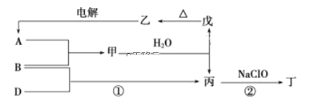
请回答:
(1)元素X在周期表中的位置是________,其简单离子的结构示意图为________。
(2)单质B电子式为________、丁电子式为________。
(3)丙中所包含的化学键类型有_______(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,1 mol NaClO参加反应时,转移2 mol电子,其离子方程式为______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)苯乙烯→聚苯乙烯__________________
(3)1,3—丁二烯与溴1,4—加成__________________
(4)2-甲基-2-溴丙烷和氢氧化钾乙醇溶液共热___________________
(5)苯甲醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镆(Mc)是115号元素,其原子核外最外层电子数是5。下列说法不正确的是
A. Mc的原子核外有115个电子 B. Mc是第七周期第VA族元素
C. Mc在同族元素中金属性最强 D. Mc的原子半径小于同族非金属元素原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com