
| A.KHCO3和MgCO3 | B.K2CO3和Na2CO3? |
| C.MgCO3和Na2CO3 | D.Na2CO3和NaHCO3 |
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaF溶液中通入足量的CO2气体: F-+CO2+H2O====HF+  ? ? |
B.NaHCO3溶液中滴入少量的石灰水: +OH-+Ca2+====CaCO3↓+2H2O? +OH-+Ca2+====CaCO3↓+2H2O? |
| C.石灰水中滴入少量的NaHCO3溶液: 2  +2OH-+Ca2+====CaCO3↓+ +2OH-+Ca2+====CaCO3↓+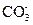 +2H2O? +2H2O? |
| D.SiO2溶于NaOH溶液中: |
 +H2O?
+H2O?查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Na2O·Al2O3·4SiO2·4H2O |
| B.Na2O·Al2O3·2SiO2·4H2O |
| C.Na2O·Al2O3·SiO2·H2O |
| D.2Na2O·Al2O3·2SiO2·4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2、CO | B.O2、CO2 | C.H2O、H2 | D.O2、H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
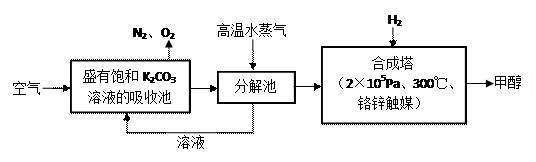 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
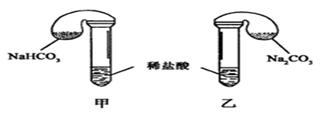
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
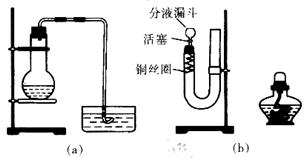
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅、二氧化硅、硅酸钠是工业上制造光导纤维的主要原料 |
| B.氯水、二氧化硫、过氧化钠均可作漂白剂 |
| C.浓硫酸、硅胶、碱石灰常用作干燥剂 |
| D.氧化铝、碳酸氢钠、氨基乙酸既可与盐酸反应又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com