
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O 3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其
原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯,玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
(1) 加快淀粉水解的速度(或起到催化剂的作用)(2分)
(2) a (1分) 温度过高 、硝酸浓度过大,导致H2C2O4进一步被氧化 (2分)
(3) 碘水或KI-I2 溶液 (2分)
(4) 布氏漏斗、吸滤瓶 (安全瓶、抽气泵不作为主要仪器) (2分)
(5) NO2+NO+2NaOH=2NaNO2+H2O (2分)
⑹溶液颜色由无色变为 紫红色(或淡紫色),且半分钟内不退色(2分) 84.0% (2分)
解析试题分析:(1) 淀粉水解时,硫酸能起到催化剂的作用,加快淀粉水解的速度;
(2) 选择a作为冷凝水入口,下进上出,可以加快冷凝速度;实验中温度过高 、硝酸浓度过大,都会导致H2C2O4进一步被氧化 ,故要控制混酸滴加速度;
(3) 检验淀粉是否水解完全所用的试剂为碘水或KI-I2 溶液,溶液由蓝色变为无色且30S不变色即水解完全;
(4) 布氏漏斗、吸滤瓶是必须使用属于硅酸盐材料的仪器;
(5) NO2+NO+2NaOH=2NaNO2+H2O
⑹滴定终点的现象为溶液颜色由无色变为紫红色(或淡紫色),且半分钟内不退色;
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
2 5
(18.5-2.5)×10-3×0.020mol c
解得c = 0.8×10-3mol
故m (二水合草酸)="126" g/mol×0.8×10-3mol = 0.1008g
则该草酸晶体样品中二水合草酸的质量分数 w = (0.1008g/0.12 g)×100% = 84.0%
考点:基础实验制备方法及注意事项,化学方程式的计算
点评:本题考查学生对制备实验一些基础操作的掌握,涉及到了化学方程式的计算,计算的关键在于是求二水合草酸在样品中的质量分数,而不是无水草酸。


科目:高中化学 来源: 题型:阅读理解
(15分)
(1)某肉制品包装上印有相关配料:精选瘦肉、食盐、胭脂红、苯甲酸钠。其中属于调味剂的是 ,属于着色剂的是 ,属于防腐剂的是 。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
①请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:
②碘是人体中不可缺少的 (选填“常量”或“微量”)元素。
③食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。食盐中加入碘化钾的碘损失率高的原因是 ;(填字母)。
a.碘化钾被氧化,造成碘化钾的碘损失率高。
b.碘化钾升华,造成碘化钾的碘损失率高。
c.碘化钾与食物中的成分发生反应,造成碘化钾的碘损失率高。
④萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.乙酸
⑤可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应化学方程式为:
5KI+KIO3 + 6HCl == 6KCl + 3I2 +3H2O,反应的现象是
⑥已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题? 。
⑶糖类、油脂、蛋白质都是人体必需的营养物质。
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和 (写结构简式)。人体中共有二十多种氨基酸,其中人体自身_____(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年江苏省如皋市第一中学高二学业水平测试化学试卷 题型:填空题
(15分)
(1)某肉制品包装上印有相关配料:精选瘦肉、食盐、胭脂红、苯甲酸钠。其中属于调味剂的是 ,属于着色剂的是 ,属于防腐剂的是 。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省江阴市一中高二上学期期中考试化学(必修)试卷 题型:填空题
(15分)
(1)(3分)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__ __。
②人体缺乏某种微量元素会发生贫血,这种微量元素是____ __。
③既能为人体提供热量,又能提供必需脂肪酸的物质是____ _ ___。
___。
(2)(5分)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___ ___。
②青霉素的作用是__ _。
③碳酸镁可治疗胃酸过多的原理是 (用离子方程表示)。
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是____ ____。
(3)(7分)生活中处处有化学,化学已渗透到我们的“衣、食、住、行”之中。
①衣:鉴别真假羊毛衫的方法是先取样,再_ _ __。
_ __。
②食:水是人类生存的必需物质。在净水过程中,明矾作为 剂;氯气或漂白粉作为 剂。
③住:玻璃和钢铁是常用的建筑材料。普通玻璃是由___ ____等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生____ ____腐蚀。
④行:铝可用于制造交通工具,铝制品不易生锈的原因是____ ____;橡胶是制造轮胎的重要原料,天然橡胶通过____ _____措施可增大强度和弹性。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三12月月考化学试卷(解析版) 题型:计算题
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
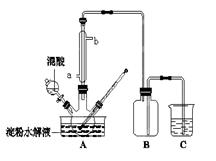
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O 3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其
原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯,玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。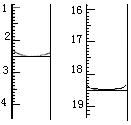
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com