
���в����ᵼ��ʵ����ƫ�ߵ���
A.�к��Ȳⶨʵ���У���ͭ�ƻ��ν��������滷�β���������������к��ȵ���ֵ
B.�к͵ζ��ⶨ������ҺŨ�ȣ���ȡ20.00mL����������Һ�ĵζ���δ�ô���������Һ��ϴ
C.��������ƽ����10.5gij���ʣ������ҩƷ��λ�÷ŷ�������ҩƷ������
D.����һ�����ʵ���Ũ����Һʱ������Ͳ��ȡŨ��Һ�����ʱ���Ӷ�����������Һ��Ũ��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���´��������������´�����������ȩ��HCHO+O2 CO2+H2O���÷�Ӧ
A����Ӧ����������ж������Է��ӺͷǼ��Է��� B������1.8gH2O����2.24L O2
C����Ӧʱ�м��Լ��ͷǼ��Լ��Ķ��Ѻ����ǵ����� D��Ϊ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)  2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K= ��
 ��֪��
��֪�� ��
��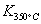 ����÷�Ӧ�� �ȷ�Ӧ��
����÷�Ӧ�� �ȷ�Ӧ��
��2����ͼ�б�ʾNO2�ı仯�������� ��
��O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v= ��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v(NO2)=2v(O2) B��������ѹǿ���ֲ���
C��NO��O2��NO2��Ũ��֮��Ϊ2��1��2 D���������ܶȱ��ֲ���
E���������������ɫ���ٱ仯
��4����С�������ʹѹǿ����ƽ���� ��Ӧ�����ƶ�����������桱����Kֵ �����������С�����䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������һ�ֳ��õĻ��ʣ��乤ҵ������������ͼ����ش��������⡣

��д����Ӧ����B�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��������C��ͨ�������Ŀ���� ��C��D������Ӧ�����з����ķ�Ӧ������������ԭ��Ӧ���� ���Ӧ�������ţ���
��Ũ����һ�㱣������ɫ�Լ�ƿ������������������û�ѧ����ʽ����ԭ�� ��
�Ƚ���ͭ��ϡ���ᷴӦ�����ӷ���ʽ�� ���÷�Ӧ��ϡ������ֵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͨ�������£����и����л�����������д������
A���е㣺������>������ B���ܶȣ�CH3CH2CH2Cl��CH3CH2Cl
C���۵㣺CH3CH2CH2Cl��CH3CH2Cl D��ˮ���ԣ�CH3CH2OH��CH3CH2CH2CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�������ȷ����

A��ͼl��������ȡ������NO2���� B��ͼ2�������о��¶ȶԻ�ѧƽ���Ӱ��
C��ͼ3������ʵ����Cl2���ռ� D��ͼ4�����ڳ�ȥCO2�����е�HCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���¶ȡ��ݻ���ͬ�ļס��������ܱ�����������������ͨ��1g N2��1g H2����������ͨ��2g N2��2g H2�����ֺ��¡����ݴﵽƽ�⣬��ز����Ƚ���ȷ����
A��ƽ��ʱN2��ת���ʣ�������2���� B��ƽ��ʱNH3��Ũ�ȣ�2c����c��
C��ƽ��ʱ��ϵѹǿ��2p����p�� D����Ӧ�ų���������2Q����Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ����ˮú���ķ�ӦΪ��C(s)+H2O(g)=CO(g)+H2(g) ��H= +131.4 kJ/mol�������ж���ȷ����
A��ˮú����Ӧ������1 mol H2(g)����131.4 KJ����
C����Ӧ�������ܺʹ��������������ܺ�
B��CO(g)+H2(g)=C(s)+H2O(l) ��H= -131.4 kJ/mol
D��ˮú����Ӧ������1���CO(g)����131.4 KJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���¶ȡ��ݻ���ͬ�ļס��������ܱ�����������������ͨ��1g N2��1g H2����������ͨ��2g N2��2g H2�����ֺ��¡����ݴﵽƽ�⣬��ز����Ƚ���ȷ����
A��ƽ��ʱN2��ת���ʣ�������2���� B��ƽ��ʱNH3��Ũ�ȣ�2c����c��
C��ƽ��ʱ��ϵѹǿ��2p����p�� D����Ӧ�ų���������2Q����Q
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com