

A.在相同温度下, > > > > |
B.室温时,若在NaZ溶液中加水,则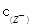 / / · · 的比值变小,若加少量盐酸,则比值变大 的比值变小,若加少量盐酸,则比值变大 |
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则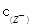 < < < < |
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且 > > > > =0.01 =0.01 |
 ;
; ;
; 所以在相同温度下,
所以在相同温度下, >
> >
> .正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O
.正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下,
HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下, >
> >
> 。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则
。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则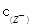 >
> >
> 。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以
。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以 =
= =
=  。错误。
。错误。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度,溶液的pH会增大 |
| B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小 |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH- B++OH- |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
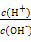 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )| A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L |
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S ) ) |
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液中存在: c(Na+) + c(H+)=c(OH—)+c(CH3COO—) |
| B.加入酚酞后加热,溶液颜色变浅 |
| C.若在该溶液再通入0.1mol HCl,存在: c(Na+)>c(CH3COO—)> c(H+) |
| D.若在该溶液中再投入0.1mol NaCl,存在: c(Na+)=c(Cl—)+c(CH3COO—)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是( )
NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是( )| A.c(NH4+) | B.c(OH-) | C.c(NH3·H2O) | D.c(NH4+)·c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×l0-7 | K1=1.54×l0-2 | K=2.95×l0-8 |
| K2=5.61×l0-11 | K2=1.02×l0-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com